Quantifizierbare Nutzen-Risiko-Bewertung von Mikronährstoffen: Von der Theorie zur Praxis
Autoren: Lisette Krul, Bas H. A. Kremer, Niels B. Lucas Luijckx & Winfried R. Leeman
Seiten 3729-3746 | Akzeptierte Autoren-Version gepostet online: 17. Mai 2016, veröffentlicht online: 17. Mai 2016
Abstrakt
Die EU Direktive für Nahrungsergänzungsmittel (2002/46/EC) regelt die erlaubte Höchst- und Mindestmenge (MPLs) für Mikronährstoffe. Um die MPLs zu bestimmen, die für bestimmte Populationsgruppen durchführbar sind, sollte ein wissenschaftlicher Ansatz verwendet werden, in welchem das Risiko einer hohen Einnahme, das Risiko eines Missverhältnisses und der Nutzen ganzheitlich bewertet werden, wobei alle verfügbaren Daten und Ausprägungsgrade sowie das Auftreten einer Wirkung berücksichtigt werden.
2004 haben Renwick et al. (ILSI Europe – International Life Science Institute, Brüssel) eine wissenschaftlich gültige, flexible und pragmatische Grundlage für einen Risiko-Nutzen-Ansatz veröffentlicht, der hier für die praktische und messbare Anwendung durch Risiko-Manager weiterentwickelt wurde. Die Anwendbarkeit des Ansatzes wird an Beispielfällen mit Eisen und Folat demonstriert. Der vorgeschlagene Ansatz kann alle relevanten, zur Verfügung stehenden Daten anwenden, einschließlich Daten aus Humanstudien, Bioverfügbarkeitsdaten, die eine Variabilität zwischen bestimmten Formen der Mikronährstoffe zeigen, und, im Fall von Tierstudien, Daten über die Vergleichbarkeit von Spezies. Der Ansatz ist daher sowohl praktisch, als auch flexibel und eignet sich daher gut für Risiko-Manager, die damit beauftragt sind, eine sichere Einnahmemenge für Mikronährstoffe in verschiedenen Formen und für bestimmte Populationsgruppen zu bestimmen.
Im Text verwendete Abkürzungen
AI = Adequate intake – ausreichende Einnahmemenge
AR = Average requirement – durchschnittlicher Bedarf
CV = Coefficient of variation – Variabilitätskoeffizient
DRV = Dietary reference value – diätetischer Referenzwert
EAR = Estimated average requirement – geschätzter Durchschnittsbedarf
ED50 = 50% effect dose levels – 50% Effektivdosis
EU = European Union – Europäische Union
FSD = EU Food Supplements Directive – EU Direktive über Nahrungsergänzungsmittel
IOM = Institute of Medicine
ILSI = International Life Sciences Institute – Internationales Institut für Lebenswissenschaften
LOAEL = Lowest Observed Adverse Effect Level – niedrigster beobachteter Grad unerwünschter Wirkungen [1]
MPLs = Maximum and minimum permitted levels – erlaubte Höchst- und Mindestmengen
NOAEL = No Observed Adverse Effect Level – kein beobachteter Grad unerwünschter Wirkungen [2]
PSI = Population Safety Index – Populations-Sicherheitsindex
RDA = Recommended daily allowance – empfohlene tägliche Verzehrmenge
SCF = Scientific Committee on Food – Wissenschaftliches Komitee für Ernährung
ULs = Tolerable upper intake levels – tolerierbare höchste Einnahmemengen
Fußnoten
[1] LOAEL: niedrigste Dosis eines verabreichten chemischen Stoffes, bei der im Tierexperiment noch Schädigungen beobachtet wurden.
[1] NOAEL: höchste Dosis eines Stoffes, die auch bei andauernder Aufnahme keine erkennbaren und messbaren Schädigungen hinterlässt.
1. Einführung
Artikel 5 der Direktive über Nahrungsergänzungsmittel der Europäischen Union (2002/46/EC) regelt die Festlegung der Höchst- und Mindestmengen (MPLs) von Vitaminen und Mineralstoffen in Nahrungsergänzungsmitteln und die nachfolgende Harmonisierung in der gesamten EU. Um die Höchstmenge von Vitaminen und Mineralstoffen zu bestimmen, schreibt die Direktive vor, dass die sicheren Höchsteinnahmemengen berücksichtigt werden, einschließlich, wo zutreffend, der unterschiedlichen Sensibilitätsgrade der einzelnen Verbrauchergruppen. Referenzeinnahmen von Vitaminen und Mineralstoffen, einschließlich der Einnahme aus anderen Nahrungsquellen, sollten ebenfalls berücksichtigt werden. Darüber hinaus sollte eine Mindestmenge pro Tagesdosis festgelegt werden, um sicherzustellen, dass die ernährungsrelevanten oder physiologisch signifikanten Mengen der Vitamine und Mineralstoffe in den Nahrungsergänzungsmitteln vorhanden sind.
2006 veröffentlichte die Europäische Kommission ein Diskussionspaper über die Festlegung der Höchst- und Mindestmengen von Vitaminen und Mineralstoffen in Nahrungsmitteln (Europäische Kommission, 2006 , European Commission. (2006). Discussion paper on the setting of maximum and minimum amounts for vitamins and minerals in foodstuffs.), verfügbar unter ec.europa.eu/food/sites/food/files/safety/docs/labelling_nutrition-supplements-discus_paper_amount_vitamins_en.pdf , um die Meinung von Interessenvertretern einzuholen.
Dieses Diskussisonspaper enthielt einen Überblick über vorhandene Modelle für das Festlegen von Höchstmengen von Vitaminen und Mineralstoffen in Nahrungsmitteln. Nach Rücksprache mit Interessenvertretern erstellte die Europäische Kommission im Juli 2007 ein Orientierungspaper über das Festlegen von Höchst- und Mindestmengen von Vitaminen und Mineralstoffen in Nahrungsmitteln (Europäische Kommission, 2007 European Commission. (2007). Orientation paper on the setting of maximum and minimum amounts for vitamins and minerals in foodstuffs. Reference no. Sanco/E4/FDA/bs(2007)D/540510. Pgs. 1–23).
In diesem Paper wird entschieden, dass das von der European Responsible Nutrition Alliance (ERNA) und der European Federation of Health Products Manufacturers Associations (EHPM) entwickelte Risikomanagement-Modell bevorzugt werden sollte (Europäische Kommission, 2007 European Commission. (2006).
Discussion paper on the setting of maximum and minimum amounts for vitamins and minerals in foodstuffs. Verfügbar unter: https://ec.europa.eu/food/sites/food/files/safety/docs/labelling_nutrition-supplements-discus_paper_amount_vitamins_en.pdf
Dies ist ein Risiko-Management-Modell, bei dem Mikronährstoffe in drei Kategorien charakterisiert und kategorisiert werden, basierend auf dem errechneten Populations-Sicherheitsindex (Population Safety Index, PSI). Für eine quantitative Charakterisierung der Sicherheit des Vitamins oder Mineralstoffes, wie sie von der Scientific Committee for Food (SCF) oder der European Food Safety Authority (EFSA) festgelegt wurden, werden die tolerierbaren höchsten Einnahmemengen im ERNA/EHPM-Modell verwendet (Europäische Kommission, 2007 European Commission. (2006). Discussion paper on the setting of maximum and minimum amounts for vitamins and minerals in foodstuffs. Verfügbar unter: https://ec.europa.eu/food/sites/food/files/safety/docs/labelling_nutrition-supplements-discus_paper_amount_vitamins_en.pdf
Die Bestimmung der ULs basiert auf den grundlegenden Prinzipien des Risikomanagements: Gefahridentifikation, Gefahrcharakterisierung, Expositionsbewertung und Risikocharakterisierung. Unerwünschte Wirkungen von Mikronährstoffen werden durch verschiedene Faktoren beeinflusst, darunter unterschiedliche Anforderungen entsprechend der Altersstufe, Gesundheitszustand, sportliche Aktivitäten und genetische Polymorphismen. Somit ist es angemessen, wo nötig, einzelne ULs für bestimmte Verbrauchergruppen und Altersstufen anzuwenden. Darüber hinaus bestimmt die Bioverfügbarkeit eines gegebenen Nährstoffes (Form) sehr stark dessen Absorption, was wiederum die Expositionsstufen beeinflusst, die sowohl nützliche, als auch unerwünschte Wirkungen hervorbringen. Daher ist die Bioverfügbarkeit für einzelne Mikronährstoffe vorzugsweise dann zu bestimmen, wenn ein UL deriviert wird (SCF, 2006). In der Praxis jedoch gibt es oft unzureichende Daten, um bestimmte ULs für einzelne Subpopulationen und/oder Formen von Mikronährstoffen abzuleiten. In den meisten Fällen wird bei den von den Behörden festgelegten ULs ein vorbeugender Ansatz angewendet, der die Stufe berücksichtigt, bei der keine unerwünschten Wirkungen bei Subpopulationen mit der höchsten Einnahmemenge berichtet werden, oder sie basieren auf der sensibelsten unerwünschten Wirkung. Unsicherheitsfaktoren werden verwendet, um das Risiko jeglicher unerwünschter Wirkungen beim UL zu minimieren, auch bei jenen sensiblen Personen.
Das Festlegen von MPLs basiert typischerweise auf den Population Reference Intakes (PRI, der von der EFSA angewendet wird (2010a EFSA. (2010a). Scientific opinion on principles for deriving and applying dietary reference values. EFSA J. 8(3):1458.[Crossref], [Google Scholar])) oder auf dem Nutrient Reference Value (NRV) (früher Recommended Daily Allowance, RDA, genannt). Dies ist die durchschnittliche tägliche diätetische Einnahmemenge, die als ausreichend erachtet wird, um den Nährstoffanforderungen bei (fast) allen gesunden Personen zu entsprechen. Der PRI oder NRV basiert wiederum auf dem durchschnittlichen Bedarf (AR), der angemessenen Einnahme (AI) oder entsprechend auf einem geschätzten durchschnittlichen Bedarf (EAR), der den Nährstoffeinnahmewert darstellt, der angesetzt wird, um dem Bedarf der Hälfte der gesunden Personen in einer Bevölkerungsgruppe zu entsprechen (EFSA, 2010a EFSA. (2010a). Scientific opinion on principles for deriving and applying dietary reference values. EFSA J. 8(3):1458.[Crossref], [Google Scholar]). Im vorliegenden Paper wird die Abkürzung AR äquivalent für EAR und AI verwendet.
Im Falle unzureichender Daten über die Sicherheit und Wirksamkeit von Mikronährstoffen, können, wie bereits angedeutet, zusätzliche Unsicherheitsfaktoren einbezogen werden, um Unsicherheiten abzudecken, wenn ein AR oder UL abgeleitet wird. Bei den meisten Mikronährstoffen ist als Folge der Bereich zwischen AR und UL eng, was bedeutet, dass einige Subpopulationen den UL mit der Einnahme eines Mikronährstoffes bereits übersteigen. Dies tritt auf bei Vitamin A, Kalzium, Kupfer, Fluorid, Jod, Eisen, Mangan und Zink. Dies wirft für politische Entscheidungsträger ein Dilemma auf. Das Festlegen von Höchstwerten, um zu versuchen sicherzustellen, dass der UL nicht von einer Subpopulation überschritten wird, könnte bei einem Teil der Population dazu führen, dass sie einem erhöhten Risiko einer unzureichenden Einnahme ausgesetzt ist. Wenn darüber hinaus AR und UL als Schwellenwerte verwendet werden, liegt keine Information über die Art und Höhe des Risikos vor, wenn diese Referenzpunkte übertroffen werden (Bruins et al., 2015 Bruins, M.J., et al. (2015). Das Thematisieren des Risikos einer unzureichenden und exzessiven Einnahme von Mikronährstoffen bedeutet: Traditioneller kontra neuer Ansatz, um ausreichende und sichere Werte von Mikronährstoffen in Lebensmitteln festzulegen. Food Nutr. Res. 59.[Taylor & Francis Online], [Web of Science ®], [Google Scholar]).
Die Folgen dieser traditionellen Methode liegen darin, dass bestimmte (gefährdete) Populationsgruppen, wie Kinder und Schwangere oder Gruppen mit höheren Anforderungen als der Durchschnitt, wie Athleten, dem Risiko eines Mangels an Mikronährstoffen ausgesetzt sind. Dies könnte ihren langzeitlichen Gesundheitszustand, ihre Widerstandsfähigkeit und ihre Körperfunktionen nachteilig beeinflussen. Darüber hinaus ist bekannt, dass die Anwendung behördlicher Maßnahmen, um eine Exposition von Subpopulationen mit höchster Empfindlichkeit gegenüber einer gegebenen Form eines Mikronährstoffes zu verhindern, auch andere Subpopulationen daran hindern kann, eine ausreichende Einnahme zu erhalten. (Verkerk, 2010 Verkerk, R. (2010). Das Paradoxon überlappender Risiken und Nutzen eines Mikronährstoffes verpflichtet zu einer Risiko-Nutzen-Analyse. Toxicology 278(1):27–38.[Crossref], [PubMed], [Web of Science ®], [Google Scholar]). Davon ausgehend, dass die FSD (EU Food Supplements Directive, EU Direktive über Nahrungsergänzungsmittel) ebenfalls die Bestimmung von MPLs verlangt, ergibt sich hieraus, dass das Risiko sowohl einer unzureichenden als auch einer exzessiven Einnahme von bestimmten Mikronährstoffen für bestimmte Subpopulationen festgelegt werden sollte. Die Art und der Ausprägungsgrad von Wirkungen sollten in dieser Hinsicht zusätzlich berücksichtigt werden, da unerwünschte gesundheitliche Folgen aufgrund der Einnahme unterhalb des PRI im Vergleich mit jenen oberhalb des UL sich beträchtlich unterscheiden können. Dies erfordert einen Ansatz, der es dem Risiko-Manager erlauben würde, die Folgen einer veränderten Einnahme abzuwägen, bezogen auf den Teil der Population mit entweder einer unzureichenden oder exzessiven Einnahme (Renwick, 2004 Renwick, A. G., et al. (2004). Risk-benefit analysis of micronutrients. Food Chem.Toxicol. 42(12):1903–1922.[Crossref], [PubMed], [Web of Science ®], [Google Scholar]).
Wenn man das Obige berücksichtigt, sollte ein wissenschaftlicher Ansatz zur Anwendung kommen, bei welchem das Risiko einer hohen Einnahme, das Risiko einer unzureichenden Einnahme und der Nutzen auf eine ganzheitliche Art bewertet werden, die die Grundlage für Risikomanagement-Entscheidungen bildet, die den optimalen Ernährungsstatus für entsprechende Populationsgruppen berücksichtigen. Um Risiko-Management-Entscheidungen sowohl für Risiken, als auch für den Nutzen zu treffen, sollten die Art, der Ausprägungsgrad, das Gefälle der Dosis-Wirkungs-Kurven und das Auftreten von Wirkungen berücksichtigt werden. Im Falle, dass darüber hinaus ein Risiko oder Nutzen für eine bestimmte Subpopulationsgruppe zutrifft, sollte dies nicht für die allgemeine Population extrapoliert werden und umgekehrt. Der Ansatz sollte außerdem unterscheiden können zwischen den chemischen Formen eines Mikronährstoffes in Bezug auf eine unterschiedliche Bioverfügbarkeit und Wirkungen als Folge dessen, dass Teile des Moleküls keine Mikronährstoffe sind, z. B. Methionin in Selenomethionin. Die größte Herausforderung besteht darin, einen Ansatz zu entwickeln, der alle zur Verfügung stehenden Daten berücksichtigt und die Quantifizierung aller relevanten Aspekte (einschließlich des Ausprägungsgrads der Wirkung und die Qualität der Daten) ermöglicht, um den optimalen Dosisbereich für bestimmte Populationsgruppen zu bestimmen. Daher besteht der Zweck dieses Papers darin, einen pragmatischen und quantitativen Risiko-Nutzen-Ansatz zu entwickeln, um unter Berücksichtigung früherer Arbeiten, die auf diesem Gebiet durchgeführt wurden, MPLs für bestimmte Mikronährstoffe und Formen abzuleiten. Das Hauptziel ist, eine Methodologie zu definieren oder Methodologien zu kombinieren, und zwar auf solch eine Art und Weise, dass für jede Populationsgruppe ein optimaler Bereich für die Einnahme von Mikronährstoffen abgeleitet werden kann, der die Risiken einer unzureichenden und exzessiven Einnahme berücksichtigt und den Dosierungsbereich für eine optimale Einnahme festlegt.
2. Derzeitige Risiko-Nutzen-Ansätze
Es wurden mehrere Risiko-Nutzen- und Risikomanagement-Ansätze während der vergangenen zehn Jahre veröffentlicht. Obwohl jedes Modell seine Vor- und Nachteile hat, machen es einige der verwendeten Ansatzpunkte – vor allem die objektive Bewertung von Nutzen und Risiken – für einen Risiko-Manager schwierig, Interpretationen abzugeben. Mehrere Ansätze, wie das dänische Budgetmodell (EU, 2006); ERNA/EHPM (2004) das 2014 durch die International Alliance of Dietary/Food Supplement Associations (Richardson, 2014 Richardson, D. P. (2014), aktualisiert wurde. Ansätze zur Analyse von Ernährungsrisiken zur Etablierung von Höchstwerten für Vitamine und Mineralstoffe in Nahrungsergänzungsmitteln. Erstellt im Namen der IADSA (International Alliance of Dietary/Food Supplement Associations). window of benefit (Palou et al., 2009 Palou, A., et al. (2009). Integration of risk and benefit analysis–the window of benefit as a new tool. Cr. Rev. Food Sci.Nutr. 49(7):670–680.[PubMed], [Web of Science ®], [Google Scholar]); der EFSA Leitfaden (EFSA, 2010b EFSA. (2010b). Guidance on human health risk-benefit assessment of foods. EFSA J. 8(7):1673.[Crossref], [Google Scholar]) und andere (EU, 2006) verwenden Punktschätzungen wie RDA und UL als Ansatzpunkt zur Bestimmung des Risikos des zu bewertenden Mikronährstoffes. Jedoch wird hierbei die Unterschiedlichkeit zwischen den Formen des Mikronährstoffes oder der Größe und dem Ausprägungsgrad des Nutzens oder Risikos, einhergehend mit den Einnahmemengen, die bei bestimmten Populationsgruppen überschritten werden, nicht berücksichtigt. Diese Methoden verwenden außerdem keinen Bewertungsgrad entsprechend dem Ausprägungsgrad der zugrundliegenden Wirkungen als Möglichkeit, um eine größere Verhältnismäßigkeit zu erzielen.
Unter den am höchsten entwickelten Risiko-Nutzen-Modellen sind jene, die versuchen, zwischen Risiko und Nutzen eine gemeinsame Gebräuchlichkeit zu entwickeln, nämlich der DALY-Ansatz (Disability-adjusted life years, behindertenangepasste Lebensjahre) und der QALY-Ansatz (Quality-adjusted life years, qualitätskorrigierte Lebensjahre), wie die BENERIS-, BRAFO- und QALIBRA-Modelle (Tijhuis et al., 2012 Tijhuis, M. J., et al. (2012). State of the art in benefit-risk analysis: Food and nutrition. Food Chem. Toxicol. 50:5–25.[Crossref], [PubMed], [Web of Science ®], [Google Scholar]). Obwohl die DALY/QALY-Ansätze sehr wertvoll sein können, wenn die Regierungspolitik über medizinische Behandlungen etc. informiert wird, ist ihre Anwendung auf Mikronährstoffe und deren bestimmte Formen zum jetzigen Zeitpunkt nicht durchführbar, da es nicht genügend relevante Eingabedaten gibt. Die European Food Safety Authority (EFSA, Europäische Behörde für Lebensmittelsicherheit) betonte mehrere zusätzliche Nachteile dieser Ansätze, einschließlich deren Anwendbarkeit auf verschiedene Zielpopulationen (z. B. Kinder, Schwangere, Erwachsene, Senioren), die Schwierigkeit, bestimmte nützliche Wirkungen zu quantifizieren, die Einbindung nicht getesteter Annahmen und das Unvermögen, Gefahrendaten aus Tierstudien zu integrieren (EFSA, 2010b EFSA. (2010b). Guidance on human health risk-benefit assessment of foods. EFSA J. 8(7):1673.[Crossref], [Google Scholar]).
Darüber hinaus berücksichtigen diese Modelle direkt oder indirekt erkrankte Populationen, während ein Behinderungsstatus im DALY-Modell keine koexistierenden Erkrankungen berücksichtigt und die Gewichtungen sind kultur-/länderspezifisch (ebenso wie die Einnahme und das Auftreten von Erkrankungen) Tijhuis et al., 2012 Tijhuis, M. J., et al. (2012). State of the art in benefit-risk analysis: Food and nutrition. Food Chem. Toxicol. 50:5–25.[Crossref], [PubMed], [Web of Science ®], [Google Scholar]). QALY Kontrastwerte variieren je nach dem jeweilig verwendeten Fragebogen, sind oft abhängig von der Gestaltung der Frage, sind im Allgemeinen nicht ausreichend sensibel und zeigen Unterschiede auf, die von der Bewertung durch Allgemeinärzte, Patienten, Familie oder der allgemeinen Öffentlichkeit abhängen (Tijhuis et al., 2012 Tijhuis, M. J., et al. (2012). State of the art in benefit-risk analysis: Food and nutrition. Food Chem. Toxicol. 50:5–25.[Crossref], [PubMed], [Web of Science ®], [Google Scholar]). Somit sind die Datenanforderungen für die Berechnung einer gemeinsamen Gebräuchlichkeit hoch und es gibt zahlreiche Herausforderungen bei der Ableitung passender Einbindungsdaten. Wenn man das Obige berücksichtigt, wurde der DALY/QALY-Ansatz als Grundlage eines generischen Ansatzes zur Anwendung durch Risiko-Manager für Mikronährstoffe als ungeeignet erachtet.
Der 2004 von der ILSI Europe Expertengruppe entwickelte Ansatz (Renwick et al, 2004 Renwick, A. G., et al. (2004). Risk-benefit analysis of micronutrients. Food Chem.Toxicol. 42(12):1903–1922.[Crossref], [PubMed], [Web of Science ®], [Google Scholar]) wurde für die Entscheidung beim Risiko-Management als am geeignetsten befunden, da er eine wissenschaftlich gültige, flexible und pragamatische Grundlage für ein Risiko-Nutzen-Management von Mikronährstoffen in Nahrungsergänzungsmitteln ist. Der Ansatz basiert auf zwei dosisabhängigen Einnahme-Inzidenz-Verhältnissen, eines für das Ausbleiben von jeglichem Nutzen, das andere für Toxizität. Jede Dosis-Wirkungs-Kurve wird von einer 50 % Wirkungsdosis (ED50) abgeleitet, als jene Dosis, die eine Wirkung bei 50 % der Population hat, und von einem Variationskoeffizienten (CV), der den Abfall der Wirkungskurve aufzeigt, welche die Abweichungen von einer Person zu anderen innerhalb der menschlichen Population berücksichtigt. Zusammen stellen diese Kurven einen Rahmen für den Dosierungsbereich zwischen Nutzen und Risiko für eine bestimmte Population zur Verfügung.
Auf der Grundlage der ED50-Werte für Nutzen und Risiko und wenn der Variationskoeffizient (CV) angewendet wird, können die Einnahmemengen in Bezug auf die Chance berechnet werden, dass eine bestimmte Wirkung eintreten kann, die als die Inzidenz aufgezeigt wird. Der ED50-Wert wird typischerweise aus einer Dosis-Wirkungs-Kurve berechnet, für die eine log-normale Verteilung biologische Variabilität darstellen soll. Sollten darüber hinaus unzureichende Daten zur Verfügung stehen, um die Dosis-Wirkungs-Kurve zu berechnen, können stattdessen Default-Werte für den CV verwendet werden, und zwar ein CV von 15 % für Nutzen und 45 % für Toxizität (Renwick et al, 2004 Renwick, A. G., et al. (2004). Risk-benefit analysis of micronutrients. Food Chem.Toxicol. 42(12):1903–1922.[Crossref], [PubMed], [Web of Science ®], [Google Scholar]). Der Ansatz vereinigt wichtige Aspekte für die Art der Gefahr, die Eignung der Daten und die typischen Unsicherheiten in Bezug auf die zur Verfügung stehenden Daten.
Um die Einnahme bei vordefinierten Inzidenzen, die auf den ED50-Werten für Nutzen und Risiko basieren, zu berechnen, haben Renwick et al. (2004 Renwick, A. G., et al. (2004). Risk-benefit analysis of micronutrients. Food Chem.Toxicol. 42(12):1903–1922.[Crossref], [PubMed], [Web of Science ®], [Google Scholar]) eine Methodologie vorgestellt. Die Berechnung der Einnahme bei vordefinierten Inzidenzen wurde wie folgt vorgeschlagen:
- Der normale CV wird umgewandelt auf eine Log-Skala, indem Sigma berechnet wird:
Sigma = (ln(CV2 +1)0.5;
- Die geometrische Standardabweichung (GSD, log geometric standard deviation) wird berechnet:
GSD = esigma
- Die log-normale Verteilung kann in Excel analysiert werden, und zwar durch die Statistikfunktion NORMSINV der zu beobachtenden Inzidenz
- Das Verhältnis der Dosen im Durchschnitt und die Inzidenz (%) werden berechnet durch:
Ratio = 10(logGSD × NORMSINV)
- Die Einnahme bei vordefinierter Inzidenz unter Berücksichtigung des ED50 wird dann berechnet:
Einnahme bei Inzidenz = ED50 × ratio
In dem gängigen Microsoft Excel Softwarepacket wird die Formel zur Berechnung der Einnahme bei der Decision-Inzidenz wie folgt angegeben:
Einnahme bei der Decision-Inzidenz bei Nutzen:
= (ED50*(10ˆ(((LOG(EXP((LN(((CV/100)ˆ2)+1))ˆ0.5)))*(NORMSINV(1-(1/incidence)))))))
Einnahme bei der Decision-Inzidenz bei Risiko:
= (ED50*(10ˆ(((LOG(EXP((LN(((CV/100)ˆ2)+1))ˆ0.5)))*(NORMSINV(1/incidence))))))
Der Einnahmebereich zwischen den Decision-Inzidenzen von Nutzen und Risiko wird als Einnahmemenge erachtet, die zum Nutzen für die Mehrheit der zu beobachtenden Population ist, ohne dass exzessive unerwünschte Wirkungen auftreten. Dieser Ansatz wird als ein sehr vielversprechender Ansatz für Risikomanagement-Zwecke erachtet, da die Bewertung von Nutzen und Toxizität mittels vergleichbarer Methoden und Werte (ED50 und CV) durchgeführt und die Umwandlung von ED50-Werten in Inzidenzen bei bestimmten Expositionswerten verrichtet werden kann. Darüber hinaus sind der Ausprägungsgrad der den ED50-Werten zugrundliegenden Wirkungen und die Unsicherheitsaspekte in Bezug auf die verwendeten Daten in dieser Methodologie mitinbegriffen, so dass sie leicht für Fälle adaptiert werden kann, wo die Wirkungen sich bei unterschiedlichen Subpopulationen unterscheiden. Darüber hinaus kann dieser Ansatz für die verschiedenen Formen des gleichen Mikronährstoffes zur Bestimmung von MPLs angewendet werden, wo Unterschiede in der Bioverfügbarkeit oder im Risiko-/Nutzen-Profil zwischen den Formen bekannt sind.
3. Methode
Während der Ansatz von Renwick et al. (2004 Renwick, A. G., et al. (2004). Risk-benefit analysis of micronutrients. Food Chem.Toxicol. 42(12):1903–1922.[Crossref], [PubMed], [Web of Science ®], [Google Scholar]) als Grundlage für die Entwicklung eines wissenschaftlichen Ansatzes für ein Risikomanagement-Model für Mikronährstoffe sowohl als flexibel, als auch als geeignet erachtet wird, sollte er weiterentwickelt werden, um ihn zu einem praktischen und quantifizierbaren Ansatz zur Anwendung für Risiko-Manager zu machen. Das Modell sollte darüber hinaus angepasst werden, um es für das Festlegen von Mikronährstoffspiegeln in Nahrungsergänzungsmitteln geeignet zu machen und, falls dies wissenschaftlich notwendig ist, um unterschiedliche Spiegel für bestimmte Formen der Mikronährstoffe und/oder Populationsgruppen abzuleiten. Der Zweck unserer Arbeit bestand darin, den früher empfohlenen theoretischen Ansatz (Renwick et al, 2004 Renwick, A. G., et al. (2004). Risk-benefit analysis of micronutrients. Food Chem.Toxicol. 42(12):1903–1922.[Crossref], [PubMed], [Web of Science ®], [Google Scholar]) in einen praktischen, quantifizierbaren Ansatz für Mikronährstoffe in Nahrungsergänzungsmitteln umzuwandeln, der direkt von Risiko-Managern verwendet werden könnte. Demzufolge wurde der Ansatz angepasst, indem Schritte hinzugefügt wurden, und er beinhaltet eine detailliertere Entwicklung der Schritte, die entscheidend sind, um den Ansatz praktikabel zu machen.
Ein Gesamtüberblick über das Design des empfohlenen Risiko-Nutzen-Ansatzes wird in Abschnitt 4.1 dargestellt und danach werden die Schritte, die von den gegenwärtigen Autoren im Vergleich zu dem Ansatz von Renwick weiterentwickelt wurden, in Abschnitt 4.2 ausgearbeitet. Es werden die Erkenntnisse der Autoren darüber angegeben, wie man ED50-Werte und VCs für Mikronährstoffe in Nahrungsergänzungsmitteln anwendet und wie man den Ausprägungsgrad der berücksichtigten Wirkung zu Inzidenzen in Bezug setzt, von denen halbwegs angenommen wird, dass sie für diese Wirkungen vertretbar sind. Daher wird eine Quantifizierung des Ausprägungsgrads der Wirkungen berücksichtigt, wohingegen die Qualität der Daten durch die Anwendung von Unsicherheitsfaktoren berücksichtigt wird. Weiterhin wird eine Anleitung angeboten, wie man die Bioverfügbarkeit von Mikronährstoffen berücksichtigt, was zu unterschiedlichen Einnahmemengen der unterschiedlichen chemischen Formen des zu bewertenden Mikronährstoffes führen kann. Beispiele relevanter Quellen über Nahrungsmittel-Verbrauchsdaten werden gegeben, einschließlich der Verbrauchsdaten von Nahrungsergänzungsmitteln. Schließlich wird eine Empfehlung gegeben, wie Risiko-Manager Daten über Risiko/Nutzen anwenden können. Um die Anwendbarkeit des vorgeschlagenen Risiko-Nutzen-Ansatzes für Mikronährstoffe in Nahrungsergänzungsmitteln zu bewerten, wurden zwei chemische Formen der Mikronährstoffe Folat und Eisen für einen Grundsatzbeweis ausgewählt (siehe Abschnitt 4.3). Es ist zu beachten, dass der vorgeschlagene Ansatz nur für offensichtlich gesunde Populationen oder bestimmte Subgruppen hiervon relevant ist, der Ansatz schließt daher erkrankte Populationen oder welche, die sich unter medizinischer Aufsicht befinden, aus.
4. Ergebnisse
4.1. Gesamtdesign des Ansatzes für Mikronährstoffe in Nahrungsergänzungsmitteln
Der gesamte Risikomanagement-Ansatz, der als geeignet für die Bestimmung der MPLs von Mikronährstoffen in Nahrungsergänzungsmitteln erachtet wird, sollte flexibel sein, um einen breiten Bereich von Daten effektiv zu beinhalten. Der vorgeschlagene Ansatz für das Risikomanagement beinhaltet die folgenden Schritte:
- Identifizierung relevanter (Sub-) Populationen auf Grundlage der beabsichtigten Verwendung der Mikronährstoffe und/oder auf Grundlage von Bedenken oder bestimmten Wirkungen, die bei (anfälligen) Subpopulationen bekannt sind;
- Das Ableiten von ED50-Werten für Nutzen und Risiko aus Schlüsseldaten für die relevanten (Sub-) Populationen;
- Ein Rating des Ausprägungsgrads der Wirkung, von dem angemessene Nutzen-/Risiko-Inzidenzen abgeleitet werden können;
- Eine Unsicherheitsbewertung einschließlich Bioverfügbarkeit und Qualität des Datensatzes, der für das Scaling der angemessenen Inzidenzen verwendet wird. Die kombinierten Unsicherheitsfaktoren und angemessene Inzidenzen führen zu Decision-Inzidenzen für Nutzen und Risiko. Diese Decision-Inzidenzen werden für die Berechnung der optimalen Einnahmemengen verwendet – äquivalent zu den MPLs – bei vordefinierten Inzidenzen für Nutzen und Risiko und unter Berücksichtigung eines anwendbaren ED50 und CV;
- Die Decision-Inzidenz wird berechnet durch: angemessene Inzidenz x Unsicherheitsfaktor (z. B. angemessene Inzidenz von 1:100 mit einem Unsicherheitsfaktor von 10 ergibt Decision-Inzidenzen von 1:1.000). Dies könnte einem Risiko-Manager ein besseres Verstehen über Unsicherheiten in Bezug auf die zu treffende Wahl geben;
- Zuweisung der Einnahmemengen für Nutzen und Risiko bei der Decision-Inzidenz;
- Die Einnahmebewertung der Mikronährstoffe kann nur für die relevanten (Sub-) Populationen in die gesamte Einnahme und in die Nahrungsergänzungsmittel-Exposition unterteilt werden;
- Vergleich der Einnahmemengen der Ergänzungsmittel bei der Decision-Inzidenz mit den gesamten Einnahmemengen für die relevanten Subpopulationen.
Ein grafisches Modell des vorgeschlagenen Ansatzes wird vorgestellt (Abb. 1) und basiert auf dem von Renwick et al. (2004 Renwick, A. G., et al. (2004). Risk-benefit analysis of micronutrients. Food Chem.Toxicol. 42(12):1903–1922.[Crossref], [PubMed], [Web of Science ®], [Google Scholar]), einschließlich dem Ausprägungsgrad der Wirkung und der Skalierung der (Unsicherheits-) Faktoren, um die Decision-Inzidenzen für Nutzen und Risiko zu bestimmen. Eine detailliertere Beschreibung der zusätzlichen und/oder weiterentwickelten Schritte wird in den nachfolgenden Abschnitten dieses Papers zur Verfügung gestellt.
Abbildung 1: Design des vorgeschlagenen Risiko-Nutzen-Ansatzes für Mikronährstoffe zur Anwendung bei der Entscheidungsfindung im Risikomanagement.
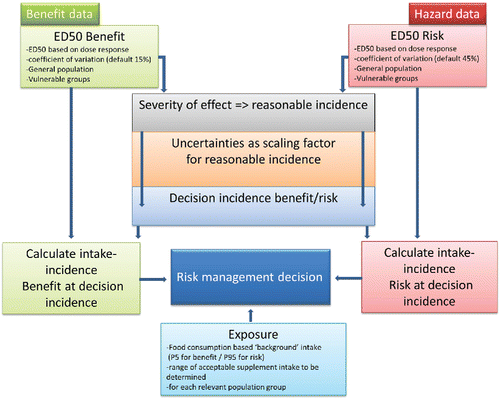
4.2. Ausarbeitung der Schritte, die weiterentwickelt wurden
4.2.1. Bestimmung der ED50-Werte für Mikronährstoffe in Nahrungsergänzungsmitteln
Die Bestimmung des ED50 wird als Ausgangspunkt der Bewertung erachtet. Zur Berücksichtigung des Nutzens eines gegebenen Mikronährstoffes sollte ein ED50-Wert oberhalb (die Anforderungen an den Mikronährstoff werden erfüllt) und unterhalb (eine unerwünschte Wirkung oder kein Nutzen als Ergebnis einer unzureichenden Einnahme ist evtl. zu erwarten) in Betracht gezogen werden. Die EFSA leitet Dietary Reference Values (DRV, diätetische Referenzwerte) ab, hierzu gehört der AR (Average requirement – durchschnittlicher Bedarf) AR (EFSA, 2010a EFSA. (2010a). Scientific opinion on principles for deriving and applying dietary reference values. EFSA J. 8(3):1458.[Crossref], [Google Scholar]). Der AR kann als Nutzen-ED50 verwendet werden, da der AR die durchschnittliche (median) Anforderung an den Mikronährstoff wiederspiegelt, die ausreichend ist für eine bestimmte Population, was per Definition bedeutet, dass 50% der Population oberhalb und 50% unterhalb dieses Wertes liegen wird (EFSA, 2010a EFSA. (2010a). Scientific opinion on principles for deriving and applying dietary reference values. EFSA J. 8(3):1458.[Crossref], [Google Scholar]; Fairweather-Taitet al., 2011 Fairweather-Tait, S. J., et al. (2011). Risk-benefit analysis of mineral intakes: case studies on copper and iron. Proc. Nutr. Soc. 70:1–9.[Crossref], [PubMed], [Web of Science ®], [Google Scholar]). Der AR ist somit die beste Einschätzung der Anforderungen, die aus veröffentlichten Daten erreicht werden kann, da jegliche zur Verfügung stehende Literatur zum Zeitpunkt der Bestimmung ausgewertet und berücksichtigt wird.
Um den Risiko ED50-Wert zu bestimmen, sollte der ausschlaggebende Datensatz zur Bestimmung der Gefahr des Mikronährstoffes zuerst ausgewählt werden. Dieser Datensatz sollte zur Identifizierung unerwünschter Wirkungen durch den Mikronährstoff bewertet werden und führt gewöhnlich zur Ermittlung von NOAEL (No Observed Adverse Effect Level, kein beobachteter Grad unerwünschter Wirkungen) oder LOAEL (Lowest Observed Adverse Effect Level, niedrigster beobachteter Grad unerwünschter Wirkungen). Der verwendete Datensatz zur Bestimmung der aktuell tolerierbaren ULs (upper levels) für Mikronährstoffe (EFSA, 2006 EFSA. (2006). Opinion of the scientific panel on food additives, flavourings, processing aids and materials in contact with food on a request from the commission related to ferrous bisglycinate as a source of iron for use in the manufacturing of foods and in food supplements. EFSA J. 299:1–17. [Google Scholar]) wird als guter Ausgangspunkt zur Bestimmung der Risiko ED50-Werte erachtet, besonders dann, wenn eine dosisabhängige Wirkung betroffen ist, da alle zur Verfügung stehende Literatur berücksichtigt und auf ihre Qualität und Gültigkeit geprüft wurde. Zur Beachtung: Der UL kann nicht als Ersatz für den ED50 verwendet werden, da der UL normalerweise keinen Wirkungsgrad hat.
Im Fall, dass der Mikronährstoff bei allen Dosierungsmengen unerwünschte Wirkungen induziert und eine Dosiswirkung nicht mit ausreichender Sicherheit bestimmt werden kann, kann die niedrigste getestete Dosis als LOAEL in Betracht gezogen werden. Davon ausgehend, dass der LOAEL eigentlich eine Wirkungsdosis ist, so wie der ED50, ist der Prozentsatz der Population, bei der die Wirkung beim LOAEL induziert ist, gewöhnlich weder angegeben, noch leicht zu bestimmen. Im Fall, dass ein LOAEL ausgewählt wird, bei dem auf Grundlage der Daten eine Wirkungsdosis unterhalb 50 % wahrscheinlich ist, kann der LOAEL vorsichtig als ED50 verwendet werden. Wenn eine höhere Wirkungsdosis in Betracht gezogen wird, kann ein Unsicherheitsfaktor für die Skalierung berücksichtigt werden (Abschnitt 4.2.3). Wenn die Substanz keine unerwünschten Wirkungen induziert hat, auch nicht bei der höchsten Dosismenge, wird diese höchste Dosismenge als NOAEL berücksichtigt. Die Verwendung eines NOAEL bei der höchsten Dosismenge als Ausgangspunkt wird eine vorsichtige Einschätzung des ED50 ergeben. Alternativ kann angenommen werden, dass die Einnahme in dieser Höhe bereits eine Dosismenge darstellt, die durch die Menge, die normalerweise erwartungsgemäß konsumiert wird, begrenzt wird. Da der NOAEL bei der höchsten getesteten Dosis auf keine Gefahr hindeutet, wird der Ausprägungsgrad der Wirkung als nicht vorhanden erachtet. In diesem Fall wird der Ausprägungsgrad beim NOAEL auf eine angemessene Inzidenz von 1:10 bezogen (Abschnitt 4.2.2). Darüber hinaus kann im Falle eines Default-CV von 45% ein CV von 15% stattdessen angewendet werden, was ebenfalls einen geringen, vorsichtigen Faktor in die Gleichung einführt.
Für relevante Subpopulationen können separate ED50 bestimmt werden, und zwar auf Grundlage der bestimmen Anforderungen, Nutzen und/oder Risiken beim Verzehr von Mikronährstoffen. Dies kann auf das Alter, das Geschlecht und/oder die Lebensphasen (z. B. Schwangerschaft) bezogen werden, für die stets Unterschiede in der Bioverfügbarkeit oder der Wirkungsparameter in Betracht gezogen werden sollten. Ein Beispiel für die Notwendigkeit dieses Ansatzes wird im Fall von Folat für Schwangere gegenüber älteren Menschen aufgezeigt (Verkerk, 2010 Verkerk, R. (2010). The paradox of overlapping micronutrient risks and benefits obligates risk/benefit analysis. Toxicology 278(1):27–38.[Crossref], [PubMed], [Web of Science ®], [Google Scholar]). Als ein Ergebnis einer bestimmten Gefahr für eine bestimme Subpopulation kann ein Risiko- und/oder Nutzen-ED50 für jede relevante Subpopulation ausgearbeitet werden. Darüber hinaus kann ein ED50 für eine akute und chronische Exposition abgeleitet werden, wenn die zur Verfügung stehenden Daten unterschiedliche Gefahren andeuten. In diesem Fall sollte der abgeleitete ED50 mit einer kurzzeitigen bzw. langzeitigen Exposition vergleichen werden.
Wenn bekannt ist, dass sich eine sehr steile Dosis-Wirkungs-Kurve ergibt, kann der ED50 auf der niedrigsten beobachteten Wirkung und/oder der schwerwiegendsten beobachteten Wirkung beruhen. Wenn die schwerwiegende Wirkung ein größeres Gesundheitsproblem hervorruft als die niedrigste Wirkung – basierend auf der errechneten Einnahme bei der Decision-Inzidenz – können entweder beide ED50-Werte oder der ED50-Wert mit der schwerwiegendsten Wirkung als Dateneingabe für die Risiko-Nutzen-Bewertung ausgewählt werden. Die Wahl sollte entsprechend dem Urteil der Expertengruppe erfolgen. Der ausgewählte ED50 sollte alle (relevanten) unerwünschten Wirkungen für die Substanz und die betreffende Population beinhalten. Darüber hinaus sollten auch der Ausprägungsgrad und die zugehörige Inzidenz berücksichtigt werden. Als ein hypothetisches Beispiel wird genannt: Anämie wird bei einem ED50 von 1 mg/kg bw/d mit einer angemessenen Inzidenz von 1:100 festgestellt, siehe Tabelle°1, und ein histologischer (reversibler) Leberschaden wird bei einer nächst höheren Dosismenge von 10 mg/kg bw/d mit einer angemessenen Inzidenz von 1:100.000 (Tabelle°1) festgestellt; der Faktor von 10 bei der Dosismenge ist viel niedriger als der Unterschied bei den angemessenen Inzidenzen, der 1.000 beträgt. In diesem Fall sollte der Leberschaden anstatt der Anämie als Ausgangspunkt ausgewählt werden, auf dem der NOAEL basiert.
4.2.2. Ausprägungsgrad der Wirkungen: Quantifizierung
Um Nutzen und Risiko abzuwägen, ist zu beachten, dass der Ausprägungsgrad von unerwünschten Wirkungen für Nutzen und Risiko meistens nicht vergleichbar ist. Darüber hinaus sollte der Ausprägungsgrad der Wirkungen in Zusammenhang stehen mit dem, was als angemessene Inzidenz der betroffenen Population erachtet werden könnte. Daher sollten die Inzidenz der Wirkungen und der Ausprägungsgrad dieser Wirkungen in einem Risiko-Nutzen-Ansatz berücksichtigt werden. Da vertretbare Inzidenzen für die meisten der unerwünschten Wirkungen derzeit nicht vorhanden sind, schlagen wir vor, stattdessen den Begriff ‚angemessene Inzidenz‘ zu verwenden. Letztendlich sollten angemessene Inzidenzen für bestimmte Wirkungen definiert werden. Diese angemessenen Inzidenzen werden – nach der Skalierung unter Verwendung der Unsicherheitsfaktoren – Decision-Inzidenzen genannt, welche jene Inzidenzen sind, die für Entscheidungen des Risikomanagements in Betracht gezogen werden.
Eine Liste von Indikatoren für den Ausprägungsgrad von unerwünschten Wirkungen gibt es von Renwick et al. (2004 Renwick, A. G., et al. (2004). Risk-benefit analysis of micronutrients. Food Chem.Toxicol. 42(12):1903–1922.[Crossref], [PubMed], [Web of Science ®], [Google Scholar]). Jedoch wurden diese Indikatoren nicht weiter quantifiziert. Eine Quantifizierung des Ausprägungsgrads der Wirkungen ist notwendig, um dies bei der Risiko-Nutzen-Bewertung zu berücksichtigen. Daher wird für jeden Indikator des Ausprägungsgrads einer Wirkung, wie bei Renwick beschrieben, eine angemessene Inzidenz vorgeschlagen. In Bezug auf die Kanzerogenität ist ein Risiko für die Bildung eines Tumors von 1 pro 106 allgemein vertretbar. Derzeit gibt es kein allgemein vertretbares Risiko für andere Wirkungen, die für die Bestimmung von angemessenen Inzidenzen verwendet werden können. Daher schlagen wir angemessene Inzidenzen für andere Wirkungen vor, die in Relation zu dem allgemein vertretbarem Risiko für Kanzerogenität von 1 pro 106 ausgearbeitet werden. Wir schlagen außerdem vor, dass klinische Anzeichen eines irreversiblen Organschadens als eine äquivalente Risikoinzidenz für eine Kanzerogenität erachtet werden (d. h. angemessene Inzidenz von 1 pro 106), und dass die Risikoinzidenz um den Faktor 10 stufenweise in verschiedenen Kategorien mit abnehmendem Risiko reduziert wird, wie Tabelle°1 zeigt. Das Festlegen von angemessenen Inzidenzen ist eher die Verantwortung des Risikomanagements und weniger die der Risikobewertung: Diese Inzidenzen sind Schätzungen davon, was die Gesellschaft als ein vertretbares Risiko in Bezug auf eine bestimmte Wirkung erachtet. Da die vorgeschlagenen angemessenen Anzeichen in dem Vergleich zwischen Nutzen/Risiko bei einem Mangel einerseits und Toxizität andererseits verwendet werden, sind die tatsächlich verwendeten Zahlen etwas willkürlich und spiegeln in erster Linie den Ausprägungsgrad einer Wirkung zahlenmäßig wieder.
Wenn bekannt ist, dass unterschiedliche Wirkungen bei unterschiedlichen Subpopulationen auftreten, sollte eine bestimmte angemessene Inzidenz für jede relevante Subpopulation abgeleitet werden.
4.2.3. Unsicherheitsbewertung
4.2.3.1. Qualität der Daten
Das für die Bestimmung der ED50-Werte verwendete Datenpaket könnte Unsicherheiten einführen, die bei der Risiko-Nutzen-Bewertung berücksichtigt werden sollten. Die Unsicherheitsbewertung dieses Ansatzes beinhaltet einen quantifizierten Korrekturfaktor für die Qualität der Daten und dafür, wie repräsentativ die Daten für die zu berücksichtigende menschliche Population sind (z. B. Berücksichtigung der Aspekte in Bezug auf Bioverfügbarkeit). In dieser Hinsicht können die normalen Korrekturfaktoren zur Umrechnung von Tierdaten in Humandaten berücksichtigt werden: Ein Faktor 10 als Default für artübergreifende Unterschiede und ein Faktor 10 für Unterschiede innerhalb der Art. Die Einbindung dieser Unsicherheitsfaktoren, die einen einseitigen, vorbeugenden Ansatz ergeben, könnte aufgrund eines Mangels zu signifikanten unerwünschten Wirkungen auf die Gesundheit in der Population führen (Renwick et al., 2004 Renwick, A. G., et al. (2004). Risk-benefit analysis of micronutrients. Food Chem.Toxicol. 42(12):1903–1922.[Crossref], [PubMed], [Web of Science ®], [Google Scholar]). Um eine derartige Situation zu vermeiden, wird vorgeschlagen, dass ein Unsicherheitsfaktor als Skalierungsfaktor eingeführt wird, um die angemessenen Inzidenzen sowohl für Nutzen, als auch für Risiko in eine Decision-Inzidenz umzuwandeln. Auf diese Weise kann beim Risikomanagement die Inzidenz einer weniger schwerwiegenden Risikowirkung mit mehr Unsicherheiten eher mit einem schwerwiegenderen Nutzen oder Risiko mit weniger Unsicherheiten verglichen werden.
Die Zuweisung von Unsicherheitsfaktoren zu einem bestimmten Datensatz kann äußerst subjektiv sein und entsprechend der Verfügbarkeit der Daten variieren, und die Berücksichtigung dieser Daten ist relevant. Für einen optimalen Vergleich sollte die Unsicherheitsbewertung für Nutzen und Risiko mit der gleichen Methodologie durchgeführt werden, um überzogene Unterschiede bei den verwendeten Unsicherheitsfaktoren zu vermeiden. Die EFSA veröffentlichte (2012 EFSA. (2012). Guidance on selected default values to be used by the EFSA scientific committee, scientific panels and units in the absence of actual measured data. EFSA J. 10(3):2579.[Crossref], [Google Scholar]) einen Leitfaden über ausgewählte Defaultwerte, die vom EFSA Wissenschaftlichen Komitee, von Wissenschaftlichen Ausschüssen und Einheiten in Ermangelung gemessener Daten (Tabelle°2) verwendet werden sollten. Dieses Dokument kann als Hintergrunddokument verwendet werden, um einen einheitlichen Ansatz zu verwenden. Der Leitfaden beinhaltet Defaultwerte für artübergreifende Extrapolation und Extrapolation innerhalb der gleichen Spezies, Extrapolation für die Dauer der Exposition, Ansätze für die Handhabung von Unzulänglichkeiten bei den zur Verfügung stehenden Daten und andere.
Tabelle 2. Von der EFSA veröffentlichte Unsicherheitsfaktoren (2012 EFSA. (2012). Guidance on selected default values to be used by the EFSA scientific committee, scientific panels and units in the absence of actual measured data. EFSA J. 10(3):2579.[Crossref], [Google Scholar]).
Es ist zu beachten, dass der CV, so wie er für die Bestimmung der Einnahmen bei vordefinierten Inzidenzen verwendet wurde, die Dosis-Wirkungs-Kurve der den Daten zugrundeliegenden Population wiederspiegelt. Daher wurden Unterschiede bei den Menschen einer betroffenen Population bereits durch den CV berücksichtigt, wenn Humandaten dem ED50-Wert zugrunde liegen. Zu beachten ist, dass ein Unsicherheitsfaktor eingeführt werden kann, wenn Informationen über eine bestimmte betroffene Subpopulation fehlen.
Im Fall, dass das Datenpaket von relativ niedriger Qualität ist oder Datenlücken enthält, die eine gute Bewertung der Relevanz oder die Brauchbarkeit der Daten verhindern, sollte die Relevanz zur Verwendung dieses Datenpakets bestimmt werden, bevor ein Unsicherheitsfaktor angewendet wird: z. B., wenn die Daten in Bezug auf die gezogene Schlussfolgerung fraglich sind, kann es zweckmäßiger sein, die Daten zu verwerfen, als einen Unsicherheitsfaktor anzuwenden.
Tabelle°2 zeigt: Unterschiede in der Toxikokinetik und Toxikodynamik bestimmen größtenteils den zu verwendenden Unsicherheitsfaktor. Bekannte Unterschiede in der Bioverfügbarkeit zwischen den getesteten Arten oder Populationen und der zu untersuchenden Population sollten daher ebenfalls berücksichtigt werden. Zu beachten ist, dass dies sowohl zu einem niedrigeren, als auch höheren zu verwendenden Unsicherheitsfaktor führen kann. Zusätzlich zur Verwendung der Bioverfügbarkeitsbewertung für die Unsicherheitsbewertung beim Extrapolieren von Tierdaten auf Menschen können die Bioverfügbarkeitsdaten zur Bestimmung von Unterschieden in der Bioverfügbarkeit der chemischen Formen von Nährstoffen verwendet werden. Im nächsten Abschnitt wird ein Leitfaden darüber zur Verfügung gestellt, wie man (die Qualität von) Bioverfügbarkeitsdaten von Mikronährstoffen bewertet.
4.2.3.2. Bioverfügbarkeit von Mikronährstoffen
Die Bioverfügbarkeit ist bei verschiedenen Formen der Mikronährstoffe unterschiedlich und beeinflusst so eine systemische Exposition und nachfolgende günstige oder unerwünschte Wirkungen. Durch die Bestimmung der MPLs der Mikronährstoffe sollten daher potentielle Unterschiede in der Bioverfügbarkeit als eine Folge der chemischen Form des Mikronährstoffes berücksichtigt werden. Die Bioverfügbarkeit wird im Allgemeinen bei der Bestimmung der tolerierbaren höchsten Einnahmemengen berücksichtigt (EFSA, 2006 EFSA. (2006). Opinion of the scientific panel on food additives, flavourings, processing aids and materials in contact with food on a request from the commission related to ferrous bisglycinate as a source of iron for use in the manufacturing of foods and in food supplements. EFSA J. 299:1–17. [Google Scholar]), für die die bioverfügbarsten Formen eines gegebenen Mikronährstoffes als ausreichend gelten, um das Risiko zu bewerten. Dies kann jedoch zu Unzulänglichkeiten führen, wenn weniger bioverfügbare Formen des Mikronährstoffes betroffen sind. Daher sollten Unterschiede in der Bioverfügbarkeit bei den chemischen Formen eines gegebenen Mikronährstoffes bewertet werden. Eine solche Variabilität wird als wichtig erachtet, wenn man eine Exposition gegenüber Polyglutamylfolaten aus Lebensmitteln mit Pteroylmonoglutaminsäure in Nahrungsergänzungsmitteln vergleicht (Gregory, 2001 Gregory, J. F. (2001). Bioavailability of nutrients and other bioactive components from dietary supplements. case study: Folate bioavailability. J. Nutr. 131:1376S–1382S.[PubMed], [Web of Science ®], [Google Scholar]).
4.2.3.2.1. Definition
Es wird rege über die Definition der Bioverfügbarkeit diskutiert, die bei der Bewertung der Bioverfügbarkeit der verschiedenen Formen der Mikronährstoffe verwendet wurde. Wenn man die Bioverfügbarkeit der unterschiedlichen Formen der Mikronährstoffe vergleicht, ist die Absorption des Nährstoffanteils der wichtigste Faktor, um dessen systemische Verfügbarkeit zu bestimmen. In der vorliegenden Arbeit wird die Bioverfügbarkeit von Mikronährstoffen als der Anteil eines Mikronährstoffes definiert, der aus der Ernährung oder dem Ergänzungsmittel aufgenommen und bei den normalen metabolischen und physiologischen Prozessen verwendet wird. Der Bioverfügbarkeitsfaktor wird als der Prozentsatz der Einnahme ausgedrückt, der vom Körper aufgenommen wird. Dies wird durch eine große Anzahl von Faktoren beeinflusst: Freisetzung aus der Nahrungsmatrix, intestinale Verdauung, Anbindung an und Transport über die intestinale Schleimhaut, systemische Verteilung und Ablagerung, metabolische und funktionale Verwendung und Ausscheidung.
In vielen Fällen jedoch wird der Begriff Bioverfügbarkeit eigentlich verwendet, um die Biowirksamkeit anzuzeigen, die ein Teil der Bioverfügbarkeit ist und die Effizienz anzeigt, mit welchem eingenommene Mikronährstoffe aufgenommen werden, und somit nur den diätetischen und intestinalen Bestandteil der Bioverfügbarkeit wiedergibt. Letzteres ist auch die Definition, die die EFSA in ihrem Bericht über tolerierbare höchste Einnahmemengen für Vitamine und Mineralstoffe verwendet (EFSA, 2006 EFSA. (2006). Opinion of the scientific panel on food additives, flavourings, processing aids and materials in contact with food on a request from the commission related to ferrous bisglycinate as a source of iron for use in the manufacturing of foods and in food supplements. EFSA J. 299:1–17. [Google Scholar]). Da der Risikomanagement-Ansatz idealerweise Ziele vorschlug, um günstige und unerwünschte Wirkungen bei einer Mikronährstoff-Exposition anzugehen und hierbei einen Systembiologie-Ansatz verwendet und alle Daten zur Bioverfügbarkeit berücksichtigt, wird die vollständigere Definition von Bioverfügbarkeit als Ausgangspunkt für die Bewertung der Bioverfügbarkeit bevorzugt. Zu beachten ist jedoch, dass gewöhnlich nur Daten über die Biowirksamkeit vorliegen.
4.2.3.2.2. Strategie der Bewertung zur Bioverfügbarkeit
Viele Prozesse und Faktoren sind für die Bioverfügbarkeit von Mikronährstoffen relevant; jene, die zu den wichtigsten gehören, werden schematisch (Abbildung 2) dargestellt. Die Prozesse und Faktoren, die im roten Kreis abgebildet sind, markieren die wichtigsten Gesichtspunkte.
Abbildung 2: Schematische Abbildung der Prozesse und Faktoren, die für die Bioverfügbarkeit von Mikronährstoffen relevant sind. Zur Beachtung: Konversionsfaktoren und Interaktionsfaktoren können integriert werden, wenn sie bekannt sind, ansonsten kann stattdessen ein Unsicherheitsfaktor verwendet werden.
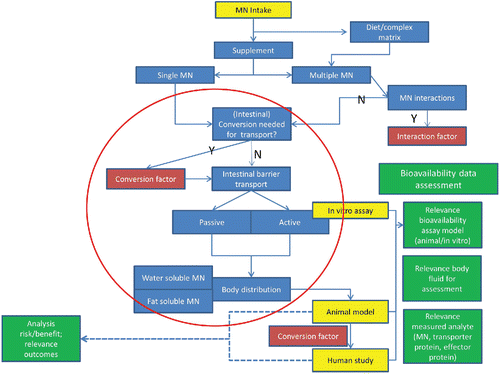
Zahlreiche andere Faktoren, die zu der Komplexität einer Bewertung der Bioverfügbarkeit von Mikronährstoffen beitragen, sind offensichtlich (Abb. 2). Jedoch wird es selten vorkommen, dass vollständige Bioverfügbarkeitsdaten für einen bestimmten Mikronährstoff sowohl für Tiere, als auch für Menschen zur Verfügung stehen. Darüber hinaus werden normalerweise Daten unterschiedlicher vorhersagbarer Werte aus verschiedenen Studientypen zur Verfügung stehen, wobei Daten über verschiedene chemische Formen des Mikronährstoffes vorliegen können. Daher sollte die Bioverfügbarkeit als Schlüsselinformation erachtet werden, wenn verschiedene chemische Formen eines Mikronährstoffes verglichen und dabei Kinetikdaten, soweit verfügbar, berücksichtigt werden. Als Richtlinie für die Bewertung der Bioverfügbarkeitsdaten werden die folgenden Erwägungen vorgestellt.
Die Menge, Beschaffenheit und Qualität der vorhandenen Bioverfügbarkeitsdaten bilden den Rahmen, um Schlussfolgerungen zu ziehen, und zwar im Hinblick auf den Vergleich der Bioverfügbarkeit zwischen mehreren chemischen Formen von Mikronährstoffen. Es gibt viele verschiedene Arten von Daten, die für jedermann zugänglich und als Bioverfügbarkeitsdaten definiert sind. Dazu gehören Daten aus in-vivo-Studien am Menschen und an Tieren, hauptsächlich Ratten, Schweine und Affen; sowie Daten aus in-vitro-Studien, die Biozugänglichkeits- und Absorptionsstudien umfassen. In Bezug auf Studien am Menschen wird die Bioverfügbarkeit in unterschiedlichen Studienformaten bewertet, z. B. durch akute und langzeitliche Studien zu Ergänzungsmitteln, als auch durch die Bewertung unterschiedlicher Marker für die Bioverfügbarkeit, wie isotopenmarkierte Studien über Mikronährstoffe und die Analyse direkter und indirekter Plasmamarker. Die Relevanz und Gültigkeit der vorhandenen Daten hängt demzufolge von Kriterien ab wie (erwarteter) Konversionswert des verwendeten Modells und Relevanz der Marker, die für die Bewertung der Absorption/Bioverfügbarkeit gemessen wurden.
Während eines Workshops über die Bioverfügbarkeit von Mikronähstoffen, der vom EURRECA Netzwerk für Exzellenz organisiert wurde, gab es unter den Experten eine allgemeine Übereinstimmung darüber, dass die durch Humanstudien erhaltenen Bioverfügbarkeitsdaten, die eine Methodik zur Analyse stabiler Isotope integriert, den Goldstandard darstellen (Casgrainet al., 2010 Casgrain, A., et al. (2010). Micronutrient bioavailability research priorities. Am. J. Clin. Nutr. 91:1423S–1429S.[Crossref], [PubMed], [Web of Science ®], [Google Scholar]). Obwohl für eine Anzahl von Mikronährstoffen, einschließlich Eisen und Folat, solche Studien fest etabliert sind, sind für die meisten Mikronährstoffe diese Daten nicht verfügbar, und die Bewertung der Bioverfügbarkeit stützt sich hauptsächlich auf Tiermodelle und/oder in-vitro Untersuchungen. Um imstande zu sein, über den Wert der Bioverfügbarkeitsdaten zu entscheiden, die aus Studien, mit Ausnahme von Tracer-Studien am Menschen, gewonnen wurden, sollten die folgenden Aspekte, wie sie in Abbildung 3 dargestellt sind, berücksichtigt werden:
| – | Translationale Werte der Testmodelle |
Abbildung 3. Schematische Darstellung zur Bewertung der Validität der Bioverfübarkeitsdaten. Grüne Linien zeigen positive und rote Linien negative Antworten an.
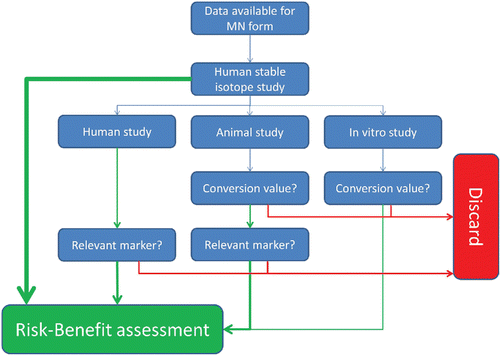
Der Goldstandard für Bioverfügbarkeitsstudien ist eine Tracer Humanstudie über die einmalige Bolusgabe eines Mikronährstoffes als Supplementierung. Wenn die Daten aus Humanstudien über einen intensiven oder langfristigen Einnahmestatus stammen, ist es nicht erforderlich, einen Translations- oder Konversionswert anzuwenden. In diesen Studien muss die Relevanz der Marker (und der beobachteten Veränderungen), die zur Bestimmung des Status zur Messung der Bioverfügbarkeit verwendet wurden, bestimmt werden (siehe: ‚Relevanz der gemessenen Marker zur Berechnung der Bioverfügbarkeit‘ weiter unten).
Den aus Tierstudien gewonnen Bioverfügbarkeitsdaten, bei denen die Bioverfügbarkeit von Referenz-Mikronährstoffen als Maßstab gegenüber Tracer Humanstudien gesetzt wurden, sollte ein höherer Stellenwert als Tierstudien beigemessen werden, bei denen keine vergleichbaren Humanstudien zur Verfügung stehen. Die folgenden Schlüsselfaktoren sollten beachtet werden, wenn Bioverfügbarkeitsdaten aus Tierstudien berücksichtigt werden:
- Spezies zeigen Unterschiede in Bezug auf luminale Wirkungen auf die Verfügbarkeit eines Mikronährstoffes. Informationen über eine unterschiedliche Bioverfügbarkeit aufgrund von Unterschieden in der Stabilität und bei den Modellspezies in Bezug auf Physiologie und Darm-Mikrobiologie konnten durch Anwendung eines Konversionsfaktors eingeführt werden;
- Spezies zeigen Unterschiede bei der Absorption in Bezug auf Mechanismus und Kinetik. Abhängig vom bekannten Transport- oder Absorptionsmechanismus, beziehungsweise vom aktiven rezeptorgesteuerten Transport oder passiver Absorption, kann die Validität der vorhandenen Bioverfügbarkeitsdaten beeinflusst werden, so dass ein Unsicherheitsfaktor eingesetzt werden kann;
- Spezies zeigen Unterschiede in der Verteilung im Körper und in der Deposition. Um imstande zu sein, die Ergebnisse aus Tiermodellen auf den Menschen zu übertragen, müssen Unterschiede in der Verteilung im Körper und in der Deposition berücksichtigt werden. Sollte es Informationen über Ähnlichkeiten oder Unterschiede hierzu geben, können Konversionsfaktoren zur Verfügung stehen, die auf der berechneten Verteilung basieren. In anderen Fällen kann ein Unsicherheitsfaktor eingesetzt werden.
Darüber hinaus sollte – besonders für in-vitro Analysen – die Korrelation zwischen in-vitro Absorptionsanalysen und der Bioverfügbarkeit im Menschen berücksichtigt werden. Eine Reihe von in-vitro Untersuchungen wurde zur Bewertung der Bioverfügbarkeit durchgeführt. Dazu gehören das dynamische in-vitro gastrointestinale TIM-Modell von TNO und zellenbasierte Untersuchungen (Arkbågeet al., 2003 Arkbåge, K., Verwei, M., Havenaar, R. and Witthöft, C. (2003). Bioaccessibility of folic acid and (6S)-5-methyltetrahydrofolate decreases after the addition of folate-binding protein to yogurt as studied in a dynamic in vitro gastrointestinal model. J. Nutr. 133(11):3678–83.[PubMed], [Web of Science ®], [Google Scholar]). Daten aus diesen Untersuchungen tragen zu der Information über die Bioverfügbarkeit eines bestimmten Mikronährstoffes bei. Jedoch stellen sie nur ein unvollständiges Bild der gesamten Aufnahmekette dar. Diese Daten können nur zusammen mit relevanten in-vivo Daten verwendet werden oder wenn es eine nachgewiesene Korrelation zwischen validen Human-Bioverfügbarkeitsdaten und den in-vitro Ergebnissen ähnlicher Mikronährstoff-Formen gibt. Wenn es keine Angaben über die Relevanz dieser in-vitro Untersuchungen gibt, sollten diese nicht für eine quantitative Risiko-Nutzen-Bewertung verwendet werden.
| – | Relevanz der gemessenen Marker zur Berechnung der Bioverfügbarkeit |
In vielen Studien wird die Bioverfügbarkeit eines Mikronährstoffes durch die Analyse von Plasmakonzentrationen des bestimmten Mikronährstoffes oder eines Metaboliten hiervon bewertet. Jedoch wird die Absorption von Mikronährstoffen nicht notwendigerweise durch eine vollständige oder unvollständige Response in den Plasmakonzentrationen für einen bestimmten Mikronährstoff wiedergegeben. Besonders im Fall von Mineralstoffen sind die Plasmaspiegel von freien oder gebundenen Mikronährstoffen oft streng reguliert und geben nicht (sofort) das absorbierte Material in Akutstudien wieder. Daher muss der Validität von Plasmamarkern (in Human- und Tierstudien) besondere Aufmerksamkeit geschenkt werden, wenn sie zur Bewertung der Bioverfügbarkeit eingesetzt werden. Die folgenden Aspekte müssen für die Bewertung der Validität von bestimmten Plasma- (oder Urine-) Biomarkern berücksichtigt werden:
- Wurde der Biomarker anhand der Tracer Humanstudien validiert und gibt es für ihn einen einheitlichen Konversionsfaktor?
- Reflektiert die Einnahme/Bioverfügbarkeit eine Veränderung der verwendeten Plasmabiomarker? Dies kann eine direkte oder indirekte Reflektion der Veränderungen der Körperspeicher sein;
- Ist der verwendete Biomarker spezifisch für den Mikronährstoff oder wird er durch mehrere Mikronährstoffe oder andere Mechanismen gesteuert?
- Welche wesentlichen Faktoren beeinflussen die Plasmaspiegel der verwendeten Biomarker oder deren Kontrolle? Zum Beispiel: Eine Entzündung reduziert die Plasmamarker des Eisenstatus (EFSA, 2006 EFSA. (2006). Opinion of the scientific panel on food additives, flavourings, processing aids and materials in contact with food on a request from the commission related to ferrous bisglycinate as a source of iron for use in the manufacturing of foods and in food supplements. EFSA J. 299:1–17. [Google Scholar]).
Abschließend lässt sich sagen, dass Bioverfügbarkeitsdaten aus Human- und Tierstudien, bei denen die Plasmabiomarker von Mikronährstoffen direkt oder indirekt verwendet werden, nur dann für die Risiko-Nutzen-Bewertung eingesetzt werden sollten, wenn relevante Biomarker die Absorption des bestimmten Mikronährstoffes wie bewertet wirklich reflektieren. Diese Marker benötigen einen fundierten wissenschaftlichen Nachweis als Grundlage.
| – | Anmerkung zu Komplikationsfaktoren |
Es ist bekannt, dass die Bioverfügbarkeit von Mikronährstoffen durch eine große Anzahl von Faktoren beeinflusst wird. Zu diesen Faktoren gehören unter anderem vergleichbare Interaktion zwischen Mikronährstoffen im Hinblick auf mukosalen Transport oder systemischen Transport oder Speicherung und Auswirkungen auf die Gesundheit oder den Ernährungszustand von Personen auf Prozesse, die die Bioverfügbarkeit regulieren.
Oft werden Mikronährstoffe in Multi-Mikronährstoff-Ergänzungsmitteln angeboten. Die Bioverfügbarkeit der einzelnen Komponenten dieser Mischungen kann aufgrund von Matrixinteraktionen oder Interaktion (z. B. Konkurrenzkampf um die Absorption) stark von den berichteten Daten für die einzelnen Mikronährstoffe abweichen. Eine ähnliche Berücksichtigung wie für Einfach-Mikronährstoffe müssen auch für die Bewertung der Bioverfügbarkeitsdaten in Betracht gezogen werden, wenn es um eine Multi-Mikronährstoff-Exposition geht. Einige Bioverfügbarkeitsdaten werden in Studien erhalten, bei denen eine vollständige Ernährung mit Tracer-markierten Ergänzungsmitteln zur Anwendung kommt; in diesem Fall können die Bioverfügbarkeitsdaten durch Wirkungen der Nahrungsmatrix beeinflusst werden.
Ein weiterer, oft ignorierter Faktor ist der Einfluss des Gesundheits- oder Mikronährstoffzustands auf die Regulierung der Absorption von Mikronährstoffen. Im Gegensatz zu Bioverfügbarkeitsstudien mit Medikamenten oder Chemikalien ist der Ausgangspunkt bei Human- und Tierstudien, bei denen Mikronährstoffe eingesetzt werden, das biologische System, das gewöhnlich den entsprechenden Mikronährstoff vollständig aufgenommen hat. Da die Aufnahmerate und somit die Bioverfügbarkeit durch den Zustand des Mikronährstoffes des Wirtes stark beeinflusst werden kann, sollte dies berücksichtigt werden, wenn die Validität der Bioverfügbarkeitsdaten für gesunde und anfällige Populationen bewertet wird (Heaney, 2001; Hurrell and Eqli, 2010). Obwohl aufgezeigt wurde, dass eine Aufnahmewirkung aufgereten ist, die jedoch entsprechend der Form des Mikronährstoffes und der Subpopulation als äußerst variabel erachtet wird, kann in vielen Fällen die Anwendung von Unsicherheitsfaktoren, die durch ein Expertenurteil bewertet werden muss, relevant sein.
4.2.4. Einnahmeberechnungen für Mikronährstoffe in Ergänzungsmitteln
Der Einnahmebereich zwischen den Nutzen- und Risiko-Decision-Inzidenzen wird als eine Einnahmemenge erachtet, die für die Mehrheit der beobachteten Population nützlich ist und keine (exzessiven) unerwünschten Wirkungen aufgrund von Mangel oder Toxizität aufweist. Durch die Verwendung der Einnahmedaten via die Ernährung der zu bewertenden Population kann die tägliche Hintergrund-Exposition bestimmt werden. Diese Hintergrund-Exposition ist der Ausgangspunkt für die Bewertung erwünschter, zusätzlicher Einnahmemengen via Nahrungsergänzungsmittel, bei denen sowohl Nutzen, als auch Risiko berücksichtig werden. Es sollte jedoch darauf hingewiesen werden, dass bei einer Limitierung die Hintergrund-Exposition nicht immer berücksichtigt wird. Zum Beispiel im Fall von Magnesium: Der UL basiert auf dem NOAEL einer zusätzlichen Mg Exposition, exklusiv des Gehalts von Mg in der Nahrung, da diese Information in der verwendeten Schlüsselstudie nicht angegeben wurde. Die dem UL zugrundeliegenden Daten sollten daher für Risiko-Nutzen-Zwecke mit Vorsicht verwendet werden, wenngleich ein Ausschließen des in der Nahrung enthaltenen Gehalts ein eher vorsichtiger Ansatz ist.
Die Wichtigkeit verlässlicher Expositionsdaten für die (Sub)Population bzw. für das betroffene geografische Gebiet ist offensichtlich, für das einige Beispiele mit verlässlichen Expositionsdaten zur Verfügung stehen. Mehrere europäische Länder haben umfangreiche Umfragen über den Lebensmittelkonsum durchgeführt; die Daten sind auf der Webseite der EFSA in der Comprehensive European Food Consumption Database verfügbar (EFSA, 2015a EFSA. (2015a). Available at http://www.efsa.europa.eu/en/datexfoodcdb/datexfooddb. [Google Scholar]). Diese Umfragen liefern im Allgemeinen sehr detaillierte Daten, die verwendet werden können, um den täglichen Verbrauch von Mikronährstoffen für mehrere Altersgruppen und (EU) regionale Unterschiede bei der Einnahme zu bestimmen. Die Wahl des Modells kann je nach entsprechender Population variieren. In den Vereinigten Staaten stellt der National Health and Nutrition Examination Survey (NHANES) detaillierte Informationen über den Gesundheits- und Ernährungszustand von Erwachsenen und Kindern in den USA (NHANES) zur Verfügung. Andere detaillierte Einnahmedaten gibt es von Flynn et°al. (2009 Flynn, A., et al. (2009). Intake of selected nutrients from foods, from fortification and from supplements in various European countries. Food Nutr.Res. 12:1–51. [Google Scholar]) für Europa, und vom Institute of Medicine (IOM, 2011) für die USA.
Für Hintergrunddaten über eine Mikronährstoff-Exposition durch Nahrungsquellen (ohne Ergänzungsmittel) werden Daten für unterschiedliche Altersgruppen und Geschlechter als Mindestanforderung erachtet. Diese Daten sollten das Folgende enthalten:
- 5% Perzentil Exposition, um mit der Nutzen-Decision-Inzidenz zu vergleichen, da die Verbrauchergruppe mit einer Einnahme bei oder niedriger als 5% Perzentil typischerweise dem großen Risiko ausgesetzt ist, einen Mangel an dem betreffenden Mikronährstoff zu erleiden;
- 50% Perzentil (oder Mittelwert/Medianwert) Exposition, um die durchschnittliche Einnahme für die gegebene Subpopulation zu vergleichen;
- 95% Perzentil Exposition, um mit der Risiko-Decision-Inzidenz zu vergleichen, da die Verbrauchergruppe mit einer Einnahme bei oder mehr als 95% Perzentil typischerweise mit jenen Verbrauchern in Zusammenhang stehen, deren Einnahme oberhalb einer Menge liegt, die möglicherweise aufgrund der Einnahme des Mikronährstoffes unerwünschte Wirkungen induziert.
Flynn et al. (2009 Flynn, A., et al. (2009). Intake of selected nutrients from foods, from fortification and from supplements in various European countries. Food Nutr.Res. 12:1–51. [Google Scholar]) und NHANES stellen auch Einnahmedaten einschließlich jene für Nahrungsergänzungsmittel und angereicherte Nahrungsmittel zur Verfügung. Diese Daten erlauben einen Vergleich der Einnahme aus Nahrungsergänzungsmitteln mit der Einnahme aus herkömmlichen und angereicherten Nahrungsmitteln sowie die Einnahme in Zusammenhang mit den Decision-Inzidenzen, die entsprechend für Nutzen und Risiko berechnet wurden. Diese werden daher als die derzeit geeignetste Datenquelle in Bezug auf die Risiko-Nutzen-Bewertung von Mikronähstoffen in Nahrungsergänzungsmitteln erachtet.
4.3. Wirksamkeitsnachweis anhand von zwei Demofällen
Der vorgeschlagene Ansatz wird auf zwei Formen von Folat und Eisen entsprechend angewendet, mit dem Ziel, einen Wirksamkeitsnachweis für Mikronährstoffe im Allgemeinen zu bestimmen. Die ausgewählten Beispiele beinhalten mehrere Themen, die als informativ für Risiko-Manager erachtet werden, und sie zeigen eine Demonstration davon, wie andere Fälle unter Einbeziehung bestimmter Mikronährstoffe und Formen innerhalb des vorgeschlagenen Ansatzes behandelt werden könnten. Dies kann auf Aspekte bezogen werden, die bestimmte relevante Subpopulationen (Folat), unterschiedliche Formen des Mikronährstoffs (Eisen) und die Einnahme unterhalb der Nutzen-Decision-Inzidenz bei P95 Einnahme (Eisen für Schwangere) einbeziehen. Es sollte erwähnt werden, dass das derzeitige Manuskript auf die Evaluierung der praktischen Anwendbarkeit des wissenschaftlichen Ansatzes fokussiert ist, der für das Risikomanagement von Mikronährstoffen verwendet werden sollte; es wird nicht beabsichtigt, eine vollständige Evaluierung des betroffenen Mikronährstoffes oder des Risikomanagement an sich zur Verfügung zu stellen.
Für die aktuellen Fälle wurden die Informationen über Nutzen, Gefahr und Exposition, die für den Wirksamkeitsnachweis verwendet wurden, ausschließlich aus öffentlich zugänglichen Review-Publikationen entnommen. Die Nutzendaten wurden aus den Daten erhalten, die den AR-Werten, wie von der EFSA abgeleitet, zugrunde liegen, die Gefahrdaten wurden aus Daten entnommen, die den ULs zugrundeliegen, wie von der EFSA abgeleitet, und die Expositionsdaten wurden dem Dutch Food Consumption Survey (RIVM, 2011 Rossum, C. T. M. van, et al. (2011). Dutch National Food Consumption Survey 2007-2010. RIVM Report 350050006. Available at http://www.rivm.nl/bibliotheek/rapporten/350050006.pdf [Google Scholar]) entnommen. Der Grund hierfür lag darin, dass diese Daten als qualitativ gut erachtet werden und Sachverständige und Manager befähigen, das Ergebnis mit diesem Ansatz mit aktuellen ARs und ULs für Folat und Eisen zu vergleichen. Die Einbindung einer neuen Wissenschaft könnte die Schlussfolgerungen der Bewertung verändern. Falls vorhanden wurden die Ergebnisse einiger neuer Daten aus Veröffentlichungen gezeigt; eine vollständige Evaluierung aller relevanten Daten für Folat und Eisen wurde jedoch als außerhalb des Anwendungsbereichs des aktuellen Manuskripts erachtet.
4.3.1. Folat
Die oxidierte, chemische Form von Folat, Pteroylmonoglutamin(fol)säure, und die bioaktiv reduzierte Form, 5-Methyltetrahydrofolat (5-MTHF), als dessen Kalziumsalz (Kalzium-L-Methylfolat), werden für eine Bewertung unter Anwendung des Risiko-Nutzen-Ansatzes als Wirksamkeitsnachweis berücksichtigt. Der Ansatz war für die allgemeine Population (Erwachsene) vorgesehen sowie für relevante Subpopulationen, nämlich Schwangere, Stillende und Personen mit einem Mangel an Vitamin B12.
4.3.1.1. Bioverfügbarkeit
Starke Abweichungen der Ergebnisse von Menschen und Ratten haben zu der allgemeinen Annahme geführt, dass Ratten nicht dafür eingesetzt werden können, um die Bioverfügbarkeit von Folsäure quantitativ zu bewerten (Gregory, 1995 Gregory, J. F. (1995). The bioavailability of folate. In: Folate: Nutritional and Clinical Perspectives (Bailey, L., ed), pp. 195–235. New York: Marcel Dekker. [Google Scholar]). In-vitro Untersuchungen haben einen deutlichen Mehrwert bei der Bewertung der Bioverfügbarkeit von Folaten, wie in einem Bericht kürzlich beschrieben (Etcheverry et al., 2012 Etcheverry, et al. (2012). Application of in vitro bioaccessibility and bioavailability methods for calcium, carotenoids, folate, iron, magnesium, polyphenols, zinc and vitamins B6, B12, D and E. Front. Physiol. 3:1–22.[Crossref], [PubMed], [Web of Science ®], [Google Scholar]). Da die dem ED50 zugrundeliegenden Daten auf Humandaten basieren, wurden diese Daten nicht weiter berücksichtigt.
Anzeichen einer Bioverfügbarkeit von Folaten basieren hauptsächlich auf Humanstudien unter Verwendung von isotopenmarkierten Folsäure-Ergänzungsmitteln oder Plasmafolat-Bewertungen nach Einzel- oder Langzeitgaben. Auf der Grundlage dieser Daten ist das Institute of Medicine (1998) zu dem Schluss gekommen, dass es valide ist anzunehmen, dass Folsäure-Ergänzungsmittel eine Bioverfügbarkeit von 85% haben, wenn sie mit der Nahrung eingenommen werden, und beinahe 100%, wenn sie mit Wasser auf nüchternen Magen eingenommen werden.
Der Goldstandard für die Bewertung der Bioverfügbarkeit ist die Messung der Einnahme von isotopenmarkierten Mikronährstoffen in gut kontrollierten Humanstudien. Für Folsäure liegen diese Studien bereits vor. Darüber hinaus gibt es im Fall von Folat ausreichende Nachweise für eine direkte Korrelation zwischen Veränderungen im Plasmafolat (= 5-MTHF-Form) oder der Folatkonzentration in den roten Blutkörperchen (Erythrozyten) durch die Einnahme von Folsäure (Pietrzik et al., 2010). Spiegel dieser aktiven Folatform im Blutkreislauf werden hauptsächlich bewertet durch standardisierte mikrobiologische Untersuchungen der Blutproben über einen Zeitraum. Auf der Grundlage dieser Daten ist es sicher anzunehmen, dass die Bioverfügbarkeit der biosynthetischen Folatformen 5-MTHF-Ca und Folsäure ähnlich sind (Pietrzik et al., 2010). Eine Anzahl Studien hat die Bioverfügbarkeit dieser beiden Ergänzungsmittel bei gesunden Erwachsenen direkt verglichen (PrinzLangenohl et al. 2003 Prinz-Langenohl, R., et al. (2003). Effect of folic acid preload on the bioequivalence of [6S]-5-methyltetrahydrofolate and folic acid in healthy volunteers. J. Inherit. Metab. Dis. 26(Suppl 1):124. [Google Scholar] and Pentieva et al. 2004 Pentieva, et al. (2004). Die kurzfristigen Bioverfügbarkeiten von (6S)-5-Methyltetrahydrofolat und Folsäure sind bei Männern gleichwertig (Human Nutr.Metab. 134:580–585. [Google Scholar]; Öhrvik 2009 Öhrvik, V. (2009). Folate bioavailability in vitro experiments and human trials. Doctoral thesis of the Swedish University of Agricultural Sciences, Uppsala, ISBN 978-91-576-7410-4. [Google Scholar]). Auf der Grundlage des Bereichs unter der Kurve (AUC) und Cmax-Messungen für die Plasmafolatspiegel kam man zu dem Schluss, dass es keine signifikanten Unterschiede in der Bioverfügbarkeit und Bioäquivalenz zwischen beiden Formen gibt. Dies stimmt mit der EFSA Beurteilung (2004) über den Gebrauch von 5-MTHF-Ca als Nahrungsergänzungsmittel überein.
Um für Folat ein Folat-Nahrungsäquivalent (Dietary Folate Equivalents, DFEs) abzuleiten, wird das Folgende berücksichtigt: Mit der Nahrung aufgenommenes Folat ist 85% bioverfügbar, wohingegen in der Nahrung natürlich vorkommendes Folat nur ungefähr 50% bioverfügbar ist. Das mit der Nahrung aufgenommene Folat ist daher 85/50 (d. h. 1,7) Mal mehr bioverfügbar (Yang et al. 2005 Yang, T. L., et al. (2005). A long-term controlled folate feeding study in young women supports the validity of the 1.7 multiplier in the dietary folate equivalency equation. J. Nutr. 135:1139–1145.[PubMed], [Web of Science ®], [Google Scholar]). Wenn somit eine Mischung aus Folsäure plus Folat aus der Nahrung konsumiert wurde, werden die DFEs wie folgt berechnet:
1 DFE = 1 μg natürlich vorkommendes Folat = 0,6 μg Folsäure aus angereicherter Nahrung oder als Ergänzungsmittel mit der Nahrung konsumiert = 0,5 μg eines auf nüchternen Magen eingenommenes Ergänzungsmittel. (EFSA, 2014 EFSA. (2014). Scientific opinion on dietary reference values for folate. EFSA J. 12(11):3893.[Crossref], [Google Scholar]; IOM, 2014
Zur Berücksichtigung der Bioverfügbarkeit im vorliegenden Rahmenwerk ist es wichtig zu beachten, dass Polymorphismen in der Methylentetrahydrofolat-Reduktase Genkonversion von Folsäure zu 5-MTHF in der Darmschleimhaut zu einer Reduzierung von systemisch vorhandenem Folat aus Folsäure führen kann, im Vergleich zu 5-MTHF, das keine Schleimhautkonversion benötigt (Pietzrik et al., 2010 Pietzrik, K., et al. (2010). Folic acid and L-5-methyltetrahydrofolate: comparison of clinical pharmacokinetics and pharmacodynamics. Clin. Pharmacokinet. 49(8):535–548.[Crossref], [PubMed], [Web of Science ®], [Google Scholar]). Darüber hinaus verhindert eine Anzahl von Medikamenten, wie Methotrexat und Trimethoprim, eine Dihydrofolat-Reduktase, ebenfalls ein wichtiges Enzym bei der Konversion von Folsäure zu 5-MTHF (Blakley, 1984 Blakley, R. L. (1984). Dihydrofolatereductase. In: Folates and Pterins: Chemistry and Biochemistry of Folates (volume 1), pp191–244. Blakley, R. L., Benkovic, S. J., editors. Wiley, New York. [Google Scholar]; Pietzrik et al., 2010 Pietzrik, K., et al. (2010). Folic acid and L-5-methyltetrahydrofolate: comparison of clinical pharmacokinetics and pharmacodynamics. Clin. Pharmacokinet. 49(8):535–548.[Crossref], [PubMed], [Web of Science ®], [Google Scholar]). Daher sollten mögliche Interaktionen beachtet werden.
4.3.1.2. Nutzen
Folat spielt eine wichtige Rolle beim Transfer von C1-Gruppen (d. h. Methyl-, Methylen- und Formylgruppen), die bei der Methylierung die Balance halten, wie bei der Biosynthese der DNA-Basen und beim Aminosäuren-Stoffwechsel (Etcheverry et al., 2012 Etcheverry, et al. (2012). Application of in vitro bioaccessibility and bioavailability methods for calcium, carotenoids, folate, iron, magnesium, polyphenols, zinc and vitamins B6, B12, D and E. Front. Physiol. 3:1–22.[Crossref], [PubMed], [Web of Science ®], [Google Scholar]). Der Ausgangspunkt zur Ableitung eine ED50 zum Nutzen ist der AR oder, bei Schwangeren der AI, die auf der Aufrechterhaltung von normalen Konzentrationen von Folat im Blut basieren. AR/AI-Werte von DEFs wurden von der EFSA erhalten (EFSA, 2014 EFSA. (2014). Scientific opinion on dietary reference values for folate. EFSA J. 12(11):3893.[Crossref], [Google Scholar]) und betragen 250, 600 und 380 µg/Tag für Erwachsene, Schwangere und Stillende entsprechend. Es ist zu beachten, dass diese AR/AI-Werte von gleicher Größenordnung sind wie die EAR-Werte, die vom Institute of Medicine abgeleitet wurden (IOM, 2014 IOM National Research Council. (2014).
Für Schwangere basiert der AI auf dem Wachstum des Fötus und des mütterlichen Gewebes sowie auf der aktiven Übertragung von Folat auf den Fötus; bei Stillenden basiert der AR auf dem normalen Folatstatus, der aufgrund der Sekretion in die Muttermilch höher ist. Zu beachten ist, dass für die Subpopulation jener Frauen, die schwanger werden möchten, ein bestimmter Nutzen in Bezug auf ein verringertes Risiko von Neuralrohrdefekten beim Fötus aufgrund der Einnahme von Folat in Betracht gezogen werden könnte. Die Einnahme von 400 µg/Tag Folsäure als Ergänzungsmittel mindestens einen Monat vor und während des ersten Trimesters der Schwangerschaft wird allgemein empfohlen, obwohl die zur Verfügung stehenden Daten über die Einnahme von Folsäure und dem Risiko, einen Neuralrohrdefekt zu erleiden, nicht dafür verwendet werden können, um den Bedarf an Folat abzuleiten (EFSA, 2014 EFSA. (2014). Scientific opinion on dietary reference values for folate. EFSA J. 12(11):3893.[Crossref], [Google Scholar]). Da nur Frauen, die schwanger werden möchten, von einer Intervention profitieren würden, wohingegen der kritische Zeitraum für eine Verhütung sehr kurz ist, basiert der AI für Frauen, die schwanger werden möchten, auf der Aufrechterhaltung eines normalen Folatstatus. Der AI für Säuglinge im Alter von 7-11 Monaten und der AR für Kinder, wie von der EFSA ausgearbeitet, wurden in diesem Fall nicht berücksichtigt, da diese Werte von gestillten Säuglingen oder Erwachsenen extrapoliert wurden (EFSA, 2014 EFSA. (2014). Scientific opinion on dietary reference values for folate. EFSA J. 12(11):3893.[Crossref], [Google Scholar]).
4.3.1.3. Ausprägungsgrad der Wirkung
Es gibt Anzeichen dafür, dass Folat, isoliert, das Risiko einer Herz-Kreislauf-Erkrankung, bestimmte Krebsarten und psychiatrische oder mentale Störungen verringern kann. Dieser Beweis ist jedoch nicht eindeutig. Der AR basiert daher auf der Aufrechterhaltung von normalen Folatspiegeln im Körper (EFSA, 2014 EFSA. (2014). Scientific opinion on dietary reference values for folate. EFSA J. 12(11):3893.[Crossref], [Google Scholar]). Wenn man berücksichtigt, dass Folat eine wichtige Rolle bei der Aufrechterhaltung der Methylierungsbalance spielt, kann die Aufrechterhaltung von normalen Folatspiegeln mit einem ‚Biomarker mit möglichen nützlichen Wirkungen‘ in Zusammenhang stehen, was eine angemessene Inzidenz von 1:100 andeutet. Diese Inzidenz betrifft auch Schwangere und Stillende. Da Humandaten betroffen sind, die eine signifikante, verfügbare Datenmenge umfassen, wird ein Skalierfaktor von 1 berücksichtigt, der auf alle Populationen anwendbar ist. Der Standard CV von 15% wird für die Nutzen-Kalkulation verwendet; er wird auch von der EFSA für die Berechnung des PRI aus dem AR verwendet.
4.3.1.4. Risiko
Der Ausgangspunkt, um das Risikolevel der Decision-Inzidenz abzuleiten, sind die Studien, die der UL Ableitung der EFSA zugrunde liegen (EFSA, 2006 EFSA. (2006). Opinion of the scientific panel on food additives, flavourings, processing aids and materials in contact with food on a request from the commission related to ferrous bisglycinate as a source of iron for use in the manufacturing of foods and in food supplements. EFSA J. 299:1–17. [Google Scholar]). Die Details der Schlüsselstudie zum Ableiten des UL von Folat sind:
- Wirkung: Das Maskieren hämatologischer Anzeichen und das Progressionspotential der neurologischen Symptome bei Personen mit Vitamin B12 Mangel als Ergebnis einer Ergänzung mit Folsäure. Es ist zu beachten, dass die EFSA erklärte, dass für natürliches (aus der Nahrung) oder anderes reduziertes Folat kein Nachweis für solch eine Wirkung mit einer hohen Einnahme assoziiert wird. Dies kann auf eine unterschiedliche Wirkung oder einen unterschiedlichen Mechanismus für die chemischen Formen bei einer hohen Einnahme hindeuten. In dieser Bewertung wird angenommen, dass nicht ausgeschlossen werden kann, dass auch eine hohe Einnahme von natürlichem oder reduziertem Folat hämatologische Anzeichen neurologischer Symptome bei Personen mit Vitamin B12 Mangel maskieren kann. Ein LOAEL von 5 mg/Tag Folsäure, als 8,3 mg/Tag Folat-Äquivalente, wird für die Ableitung des ED50 erachtet.
- Reversibilität: Potentielle neurologische Folgen werden in der Natur als irreversibel erachtet.
- Population: Risikopersonen sind jene Personen mit einem (nicht diagnostizierten) Mangel an Vitamin B12, wie bei Personen mit perniziöser Anämie (PA) und anderen Erkrankungen, die mit einer Kobalamin-Malabsorption in Zusammenhang stehen, und Gruppen, die Tierprodukte meiden, als Ergebnis einer marginalen Einnahme von Vitamin B12, wie Veganer und Makrobiotiker. Es sind keine Daten vorhanden, die darauf hindeuten, dass es andere Risikopopulationen gibt. Die EFSA erachtet den abgeleiteten UL, und als solchen die dem UL zugrundeliegenden Daten, als anwendbar auch für Schwangere oder Stillende und Kinder (auf Basis des Körpergewichts).
- Art der Studie: Fallberichte (Exposition von mehreren Tagen bis zu 10 Jahren), Anwendung von Folsäure-Ergänzungsmittel.
Auf Grundlage der vorliegenden Daten konnte ein ED50 aufgrund fehlender Dosis-Wirkungs-Daten nicht abgeleitet werden. Daher wird ein LOAEL von 5 mg/Tag Folsäure, was 8,3 mg/Tag (8.300 µg/Tag) Folat entspricht, als ED50 erachtet.
Es ist zu beachten, dass der LOAEL auf Studien basiert, die mit Personen mit an einem Mangel an Vitamin B12 durchgeführt wurden, und daher nicht repräsentativ für die allgemeine Population ist. Wenn man jedoch berücksichtigt, dass die Prävalenz perniziöser Anämie in Westeuropa zwischen 1,2 und 1,98 pro 1.000 (meistens bei älteren Personen) beträgt, und wenn man berücksichtigt, dass Veganer und Makrobiotiker ebenfalls eine marginale Einnahme von Vitamin B12 riskieren, kann diese Auswirkung ebenfalls als relevant für die allgemeine Population erachtet werden und wird zu einem späteren Zeitpunkt diskutiert.
4.3.1.5. Ausprägungsgrad der Gefahr
Allgemeine Population
Für die allgemeine Population sind keine unerwünschten Wirkungen als Ergebnis der Einnahme von Folsäure oder 5-MTHF bekannt, daher kann der ED50 mit ‚Biochemischen Veränderungen innerhalb oder außerhalb des homöostatischen Bereichs und ohne bekannte Folgen‘ in Zusammenhang stehen, was eine angemessene Inzidenz von 1:10 mit einem Skalierfaktor von 2 aufgrund der Anwendung eines LOAEL für den ED50 andeutet. Für die allgemeine Population, einschließlich Kindern, wird daher ein Entscheidungsrisiko einer 1:20 Inzidenz berücksichtigt. Der Standard CV von 45% wird für die Risikokalkulationen angewendet.
Population mit einem Mangel an Vitamin B12
Die berücksichtigte Gefahr ist ihrer Natur nach aufgrund potentieller neurologischer Wirkungen irreversibel, was in Zusammenhang steht mit ‚Klinischen Anzeichen, die auf einen Organschaden hindeuten‘, was auf eine angemessene Inzidenz von 1:1.000.000 hindeutet. Die Prävalenz der Population mit Personen, die an einem Mangel an Vitamin B12 leiden, ist bekannt und könnte dazu verwendet werden, die angemessene Inzidenz gegenüber einer Decision-Inzidenz für die allgemeine Population zu konvertieren und die Prävalenz in dieser Subgruppe zu korrigieren. Da jedoch die Gruppe der Veganer und Makrobiotiker innerhalb der allgemeinen Population bislang nicht bekannt ist, wurde entschieden, die Population mit einem potentiellen Mangel an Vitamin B12 als eine separate Population zu nehmen.
Da der ED50 von 8.300 µg/Tag auf einem LOAEL mit fehlenden Dosis-Wirkungs-Daten basiert und da Humandaten berücksichtigt werden, die eine signifikante Anzahl von verfügbaren Daten umfassen, wird ein Skalierfaktor von 2 berücksichtigt. Da die angemessene Inzidenz von 1:1.000.000 bereits das Maximum erreicht hat, wird eine Risiko-Decision-Inzidenz von 1:1.000.000 für diese Population berücksichtigt. Der Standard CV von 45% wird für die Risikokalkulationen verwendet.
4.3.1.6. Risiko-Nutzen-Analyse
Die Berechnungen für die Einnahme bei vordefinierten Nutzen/Risiko-Inzidenzen sind für die allgemeine Population in Tabelle 3 dargestellt. Tabelle 4 gibt einen Überblick über die Einnahmewerte für jede der betreffenden Subpopulationen bei den entsprechenden Decision-Inzidenzen. Darüber hinaus werden in der vorliegenden Bewertung relevante Einnahmemengen via die Nahrung angegeben. Im vorliegenden Fall wurden die Einnahmemengen für die Ernährung in den Niederlanden verwendet, entsprechend den Meldungen des RIVM (2011 Rossum, C. T. M. van, et al. (2011). Dutch National Food Consumption Survey 2007-2010. RIVM Report 350050006. Available at http://www.rivm.nl/bibliotheek/rapporten/350050006.pdf [Google Scholar]), die für andere Länder/Regionen nicht repräsentativ sein dürften. Länderspezifische Einnahmedaten für andere Zielpopulationen sollten berücksichtigt werden, einschließlich der Ernährungsgewohnheiten in bestimmten Regionen. Die niedrigste P5 Einnahmemenge und die höchste P95 Menge für Erwachsene werden für die Bewertung berücksichtigt, um den Nutzen und entsprechend das Risiko zu bewerten. Bei Kindern entsprechen die ED50-Werte denen von Erwachsenen auf Grundlage des Körpergewichts; diese Subgruppe wurde für die vorliegende Bewertung nicht berücksichtigt.
Tabelle 3. Folat Einnahmeberechnungen (Folat-Äquivalente in der Nahrung) bei vordefinierten Inzidenzen für Nutzen und Risiko.
Tabelle 4. Überblick über ED50-Werte, Einnahme bei Nutzen/Risiko-Decision-Inzidenz und Einnahme von Folat (Folat-Äquivalente in der Nahrung) via die Nahrung.
Unter Berücksichtigung der Nutzen/Risiko-Decision-Inzidenzen in Zusammenhang mit unterschiedlichen Einnahmemengen von diätetischem Folat (in Folat-Äquivalenzen [FE]) (Tabelle 4) kann zusammengefassend gesagt werden:
- Die Einnahme in Zusammenhang mit einer Nutzen-Inzidenz von 1:100 (bei 354 µg/Tag) für Erwachsene in der allgemeinen Population ist oberhalb der P50-Einnahme via Nahrung;
- Die Einnahme in Zusammenhang mit einer Risiko-Inzidenz von 1:20 (bei 4.100 µg/Tag) für Erwachsene in der allgemeinen Population ist weit oberhalb der P95-Einnahme via Nahrung von 492 µg/Tag;
- Eine Ergänzungseinnahme von 4.100-492 (P95 Einnahme) = 3.608 µg Folat-Äquivalente/Tag könnte für fast alle Personen in der allgemeinen Öffentlichkeit als nützlich erachtet werden, im Besonderen für Schwangere und Stillende. Es sollte jedoch beachtet werden, dass Personen der allgemeinen Öffentlichkeit, denen nicht bewusst ist, dass sie einen Mangel an Vitamin B12 haben, einen Folatspiegel erhalten könnten, der in Zusammenhang mit einem signifikanten Risiko stehen kann, wenn eine Einnahme von maximal 4.100 µg/Tag erwogen und die Einnahme bei der Risiko-Decision-Inzidenz von 1.100 µg/Tag für diese Population berücksichtigt wird.
- Für die allgemeine Population, wenn berücksichtigt wird, dass Personen nicht bewusst ist, dass sie einen Mangel an Vitamin B12 haben, kann daher eine maximale Ergänzungseinnahme von 1.100-492 (P95 Einnahme) = 608 µg/Tag berücksichtigt werden. Diese Ergänzungseinnahme deckt die Einnahme bei der Nutzen-Entscheidung von 354 µg/Tag sowie die empfohlene zusätzliche Einnahme von 400 µg/Tag für Frauen, die schwanger werden möchten, um einen Neuralrohdefekt zu vermeiden (EFSA, 2014 EFSA. (2014). Scientific opinion on dietary reference values for folate. EFSA J. 12(11):3893.[Crossref], [Google Scholar]);
- Für Schwangere beträgt die Einnahme bei der Nutzen-Decision-Inzidenz 850 µg/Tag, was das Wachstum des fetalen und des mütterlichen Gewebes abdeckt sowie den aktiven Transfer von Folat zum Fötus, um normale Folatspiegel im Blut aufrechtzuerhalten. Für Frauen im gebärfähigen Alter ist eine Einnahme von Folat von 125 (bei P5) bis 355 (bei P95) µg/Tag via die Nahrung angesetzt; diese Einnahme ist unterhalb der Einnahme bei der Nutzen-Decision-Inzidenz von 850 µg/Tag. Eine Ergänzungseinnahme von 725 µg Folat/Tag wird den Teil der Population, der sich bei und über der P5-Einnahme via die Nahrung befindet, auf eine Einnahme bei oder über 850 µg/Tag anheben. Der Teil der Population, der bei der P95-Einnahme via die Nahrung (355 µg/Tag) solch eine Dosis erhält, wird dann eine Exposition von 1.080 µg/Tag erfahren. Diese Einnahme ist weit unterhalb der Einnahme bei der Decision-Risiko-Inzidenz von 4.100 µg/Tag und deckt ebenfalls die Einnahme bei der Decision-Risiko-Inzidenz von 1.100 µg/Tag für die Population mit einem Mangel an Vitamin B12. Es ist anzumerken, dass die berücksichtigte Ergänzungseinnahme von 725 µg/Tag weit oberhalb der empfohlenen zusätzlichen Einnahme von 400 µg/Tag für Schwangere in den ersten drei Monaten der Schwangerschaft liegt, um Neuralrohrdefekte zu vermeiden (EFSA, 2014 EFSA. (2014). Scientific opinion on dietary reference values for folate. EFSA J. 12(11):3893.[Crossref], [Google Scholar]);
- Die bevorzugte Ergänzungseinnahme für Stillende ist aufgrund der Sekretion von Folat in die Muttermilch höher als die der allgemeinen Population. Ein höherer Bedarf an Folat, im Vergleich zur erwachsenen allgemeinen Population, von 186 µg/Tag ist notwendig im Vergleich zur allgemeinen Population, um die Einnahme bei der Nutzen-Decision-Inzidenz von 540 µg/Tag für Stillende zu erreichen. Wenn man die maximale Ergänzungseinnahme von 608 µg/Tag, entsprechend der Berechnung für die allgemeine Population, die auch Personen mit einem Mangel an Vitamin V12 schützt, berücksichtigt, kann eine Ergänzungseinnahme von 794 µg/Tag in Betracht gezogen werden.
- Ein Risiko-Manager kann zu dem Schluss kommen, dass auf Grundlage der Einnahmemengen für Erwachsene, die von der Subpopulation der 51- bis 69jährigen abgeleitet wurde, eine niedrigere Einnahme der Folat-Ergänzung empfohlen werden kann, und zwar auf Grundlage der Einnahmemengen für die entsprechenden Altersgruppen, für die eine niedrigere Einnahme berichtet wird (Daten werden nicht gezeigt);
- In Fall, dass eine höhere Einnahme des Ergänzungsmittels berücksichtigt wird, die die Einnahme beim Decision-Risiko-Index von 1.100 µg/Tag für Personen mit einem Mangel an Vitamin B12 übersteigt, könnte das mögliche zusätzliche Risiko für die allgemeine Population, die sich eines Mangels an Vitamin B12 nicht bewusst ist, ebenfalls berücksichtigt werden, wenn man die Prävalenz perniziöser Anämie in Westeuropa in Betracht zieht, die Berichten zufolge zwischen 1,2 bis 1,98 pro 1.000 schwankt. Es ist zu beachten, dass Vegetarier und Veganer ebenfalls eine marginale Einnahme von Vitamin B12 riskieren und dass diese Subgruppe (deren Größe oft nicht bekannt ist) innerhalb der allgemeinen Population auch für die jüngeren Altersgruppen von Relevanz ist.
Es ist zu beachten, dass L-5-MTHF, egal ob aus der Nahrung oder als Ergänzung, ein niedrigeres Potential für die Maskierung von Symptomen eines Vitamin B12 Mangels hat (Pietrzik et al. 2010). Darüber hinaus unterliegt die zellulare Aufnahme von zirkulierendem L-5-Methyl-THF einer strengen zellularen Kontrolle, wohingegen Pteroylmonoglutaminsäure (Folsäure), die keiner zellularen Kontrolle unterliegt, einbehalten wird, sogar bei Personen, die mit Folat reichlich ausgestattet sind. Aus diesen Gründen weisen Pietzrik et al. (2010 Pietzrik, K., et al. (2010). Folic acid and L-5-methyltetrahydrofolate: comparison of clinical pharmacokinetics and pharmacodynamics. Clin. Pharmacokinet. 49(8):535–548.[Crossref], [PubMed], [Web of Science ®], [Google Scholar]) darauf hin, dass L-5-MTHF für die Anwendung in Folat-Langzeittherapien berücksichtigt werden sollte, aber auch in Situationen nahe der Risiko-Decision-Inzidenz.
4.3.1.7. Einbindung neuerlicher Daten
Kürzlich wurden einige Veröffentlichungen verfügbar, die für eine weitere Detailarbeit bei der Risiko-Nutzen-Analyse verwendet werden können.
Das National Toxicology Program (NTP) veröffentlichte den Entwurf einer Monographie über die Identifizierung von Forschungsanforderungen für die Bewertung der sicheren Anwendung von Folsäure in hohen Einnahmemengen (NTP, 2015 NTP. (2015). National toxicology program. Draft NTP monograph for the expert panel: identifying research needs for assessing safe use of high intakes of folic acid. (Available at http://ntp.niehs.nih.gov/ntp/about_ntp/ntpexpanel/2015/draft_monograph_folic_acid_508.pdf; July, 2015). [Google Scholar]). In diesem Monographie-Entwurf wurden vier Kategorien von Gesundheitseffekten ermittelt, die von hoher Bedeutung sind. Diese Kategorien wurden auf der Grundlage von berichteten unerwünschten Wirkungen von Folsäure in Studien mit einer Einnahme von 400 µg/Tag oder Blutspiegeln über dem Mangelbereich identifiziert und umfassen Krebs, Wahrnehmung und Vitamin B12, Überempfindlichkeit und Schilddrüsen- und Diabeteserkrankungen. Leider enthielt der Monographie-Entwurf keine Ergebnisse der Bewertungen dieser unerwünschten Wirkungen. Der ED50, der für Personen mit einem Mangel an Vitamin B12 im zuvor aufgeführten Fall berücksichtigt wurde, basierte auf der Maskierung hämatologischer Anzeichen und dem Progressionspotential der neurologischen Symptome, für die die höchste angemessene Inzidenz von 1:1.000.000 bereits berücksichtigt wurde. Mit einem bereits auf die höchste angemessene Inzidenz bezogenen ED50 kann nur für neue unerwünschte Wirkungen mit einem ED50 unterhalb des für den zuvor angeführten Fall verwendeten ED50 die Einnahme bei der Risiko-Decision-Inzidenz beeinflusst und entsprechend für Risikomanagement-Zwecke in Betracht gezogen werden.
Für die allgemeine Population wird eine angemessene Inzidenz von 1:20, bezogen auf den Mangel an unerwünschten Wirkungen, berücksichtigt. In Fällen, bei denen schwerwiegende unerwünschte Risiken wie Krebs, Überempfindlichkeit oder Schilddrüsen- und Diabeteserkrankungen in Zusammenhang mit hohen Einnahmemengen durch die Öffentlichkeit im Allgemeinen stehen, steigt die angemessene Inzidenz auf bis zu 1:1.000.000 beträchtlich an. Derartige Wirkungen würden daher die kalkulierte Einnahme bei der Decision-Inzidenz signifikant beeinflussen. Die Auswertung aller verfügbaren relevanten Nachweise ist daher von größter Wichtigkeit, bevor Festlegungen finalisiert werden. Es ist zu beachten, dass die Einbindung einer Vitamin B12 Supplementierung eine Strategie für das Risikomanagement sein kann, die jedoch in diesem Fall nicht berücksichtigt wurde.
Es ist bekannt, dass Methotrexat (MTX), das als Arzneimittel bei rheumatischer Arthritis verwendet wird, das Folat in den Zellen verringert, wie in den Blutwerten der Hepatozyten und peripheren Lymphozyten bei mit MTX behandelten Personen dokumentiert wurde. Ein Mangel an Folat kann Nebenwirkungen verursachen, wie einen schmerzenden Mund, Magenprobleme wie Übelkeit oder Bauchschmerzen, Leberprobleme oder Probleme bei der Produktion von Blutzellen. Eine Folsäure-Supplementierung (0,5 bis 2 mg/täglich) kann diese durch MTX verursachten Nebenwirkungen verbessern, indem die Häufigkeit und der Schweregrad der Nebenwirkungen reduziert wird, ohne dass die Wirksamkeit von MTX bei der Behandlung von rheumatischer Arthritis verringert wird (Shea et al. 2013 Shea, B., et al. (2013). Folic acid and folinic acid for reducing side effects in patients receiving methotrexate for rheumatoid arthritis (Review). Cochrane Database Syst. Rev. 5. DOI: 10.1002/14651858.CD000951.pub2.[Crossref], [Web of Science ®], [Google Scholar]). Die Auswirkung von MTX auf die Folat Depletion kann in Betracht gezogen werden, wenn mehr Informationen über die Dosis-Wirkung-Relation bekannt sind, was derzeit nicht der Fall ist. Da eine Verschreibung von MTX gewöhnlich unter ärztlicher Aufsicht geschieht, ist dies außerhalb des Zweckbereichs des Risikomanagements für Supplementierungen.
4.3.2. Eisen
Die chemischen Formen Eisensulfat und Eisenbisglycinat werden für die Bewertung anhand des Risko-Nutzen-Ansatzes als Wirkungsnachweis berücksichtigt. Eine hoch dosierte Eisen-Supplementierung ist normalerweise auf einen begrenzten Zeitraum beschränkt, obwohl Eisen gewöhnlich auch in Multivitaminen vorkommt, die für einen längeren Expositionszeitraum gedacht sind. Für den vorliegenden Fall lag der Schwerpunkt für die Gefahr bei einer subakuten Exposition, um eine kurzzeitige hochdosierte Eisen-Supplementierung abzudecken. Im Fall, dass auch chronische Wirkungen in Betracht gezogen werden müssen, können die ED50-Werte für eine subakute und chronische Exposition als nebeneinander liegend erachtet werden.
4.3.2.1. Bioverfügbarkeit
Nach der oralen Gabe tragen sowohl Eisensulfat, als auch Eisenbisglycinat zum intraluminalen Vorrat an anorganischem, Nicht-Hämeisen im Darm bei. Eisenbisglycinat wird unbeschädigt in die Schleimhautzellen des Darms aufgenommen und anschließend in seine Komponente Eisen und Glycin getrennt; der Eisenteil von Eisenbisglycinat wird wie jede andere Quelle von Eisen verstoffwechselt (EFSA, 2006 EFSA. (2006). Opinion of the scientific panel on food additives, flavourings, processing aids and materials in contact with food on a request from the commission related to ferrous bisglycinate as a source of iron for use in the manufacturing of foods and in food supplements. EFSA J. 299:1–17. [Google Scholar]). Im Gegensatz dazu wird das wasserlösliche Eisensulfat vor der Absorption ionisiert. Die Absorption von Nicht-Hämeisen wird bekanntlich als Ergebnis von Inhibitoren, wie Kalzium oder Polyphenolbestandteilen in Getränken, oder Steigerungsmitteln aus der Nahrung, wie Muskelgewebe aus verschiedenen Nutztieren, oder Ascorbinsäure beeinflusst. Auf der Grundlage von Humanstudien bei Personen mit Eisenmangel kann angenommen werden, dass die spezifische Bioverfügbarkeit von Eisenchelaten, wie eisenhaltiges Bisglycinat, bei Erwachsenen eine höhere Bioverfügbarkeit hat als Eisensulfat (Ferrari et al., 2012 Ferrari, P., et al. (2012). Treatment of mild non-chemotherapy-induced iron deficiency anemia in cancer patients: comparison between oral ferrous bisglycinate chelate and ferrous sulfate. Biomed Pharmacother. 66(6):414–418. doi: 10.1016/j.biopha.2012.06.003.[Crossref], [PubMed], [Web of Science ®], [Google Scholar]; Milman et al., 2014 Milman, N., et al. (2014). Ferrous bisglycinate 25 mg iron is as effective as ferrous sulfate 50 mg iron in the prophylaxis of iron deficiency and anemia during pregnancy in a randomized trial. J. Perinat. Med. 42(2):197–206. doi: 10.1515/jpm-2013-0153.[Crossref], [PubMed], [Web of Science ®], [Google Scholar]); bei Schulkindern mit einem Eisenmangel ohne Anämie gibt es jedoch keine Anzeichen dafür, dass es unterschiedliche Absorptionsraten gibt (Duque et al, 2014 Duque, X., et al. (2014). Effect of supplementation with ferrous sulfate or iron bis-glycinate chelate on ferritin concentration in Mexican schoolchildren: a randomized controlled trial. Nutr. J. 13:71–81.[Crossref], [PubMed], [Web of Science ®], [Google Scholar]). In der Stellungnahme der EFSA (2006 EFSA. (2006). Opinion of the scientific panel on food additives, flavourings, processing aids and materials in contact with food on a request from the commission related to ferrous bisglycinate as a source of iron for use in the manufacturing of foods and in food supplements. EFSA J. 299:1–17. [Google Scholar]) über die Anwendung von Eisenbisglycinat in der Lebensmittelherstellung und als Nahrungssupplementierung ist man zu dem Schluss gekommen, dass keine signifikanten Unterschiede in der Bioverfügbarkeit bei Säuglingen mit normalem Eisenstatus und Bioverfügbarkeitsspiegeln, die bei angereicherten Lebensmitteln variierten, beobachtet wurden. Daher wird für den betreffenden Fall angenommen, dass die Absorption von Eisensulfat und Eisenbisglycinat bei Säuglingen mit dem gleichen Nahrungstyp eher vergleichbar ist. Für Personen mit Eisenmangel hat das eisenhaltige Bisglycinat eine 2-5fach höhere Absorption beim Vergleich mit Eisensulfat, was der Risiko-Manager berücksichtigen sollte, wenn er die Form von Eisen in einem Ergänzungsmittel auswählt.
4.3.2.2. Nutzen
Das Institute of Medicine (IOM, 2001 IOM National Research Council. (2001). Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Zinc; Available at http://www.nap.edu/catalog/10026.html. [Google Scholar]) berichtete, dass wichtige subklinische und klinische Folgen eines Eisenmangels folgende sind: Beeinträchtigung der physikalischen Arbeitsleistung, Entwicklungsverzögerung, kognitive Beeinträchtigungen und der unerwünschte Ausgang von Schwangerschaften. Diese unerwünschten Folgen eines Eisenmangels sind einhergehend mit einem Grad an Eisenmangel, der ausreichend ist, um eine messbare Anämie hervorzurufen, die der einfachste identifizierbare Indikator für einen funktionalen Eisenmangel ist. Das Institute of Medicine leitete einen EAR ab, der auf der Notwendigkeit basiert, eine normale funktionale Eisenkonzentration aufrechtzuerhalten, jedoch nur ein minimaler Vorrat, der bezogen ist auf eine Serum-Ferritin Konzentration von 15 µg/L. Jedoch erachtet eine neuere Bewertung der EFSA (2015b EFSA. (2015b). Scientific opinion on dietary reference values for iron. EFSA J. 13(10):4254.[Crossref], [Google Scholar]) diesen Serum-Ferritin Spiegel als unzureichend, wenn man berücksichtigt, dass bei diesem Spiegel der Vorrat bei Schwangeren bei der Geburt nahezu auf Null absinken würde. Daher erwägt die EFSA einen Sollwert von 30 µg/L für Serum-Ferritin, was einen angemessenen Spiegel für den Vorrat an Eisen für alle Populationen wiedergibt (EFSA, 2015b EFSA. (2015b). Scientific opinion on dietary reference values for iron. EFSA J. 13(10):4254.[Crossref], [Google Scholar]). Der Ausgangspunkt für die Kalkulation der ED50-Werte ist der AR-Wert für erwachsene Männer und postmenopausale Frauen, wie von der EFSA abgeleitet (2015b EFSA. (2015b). Scientific opinion on dietary reference values for iron. EFSA J. 13(10):4254.[Crossref], [Google Scholar]). Für die vorliegende Bewertung wird daher ein ED50 von 6 mg Eisen/Tag für die allgemeine (erwachsene) Population erachtet. Die Populationen der prämenopausalen Frauen (einschließlich Schwangere und Stillende) werden separat nicht weiter berücksichtigt, da die Einnahme via die Nahrung für diese Subpopulationen nicht bekannt und der AR für diese Populationen geringfügig höher ist (7-8 mg Eisen/Tag) als der AR für Erwachsene, was daher ein eher vorsichtiger Ansatz ist.
4.3.2.3. Ausprägungsgrad der Wirkung
Davon ausgehend, dass Eisen eine wichtige Rolle bei der Vorbeugung von Änamie spielt, kann die Aufrechterhaltung von normalen Eisenspiegeln mit einem ‚Biomarker mit potentiellen nützlichen Wirkungen‘ in Zusammenhang stehen, was auf eine angemessene Inzidenz von 1:100 hindeutet. Da der von der EFSA ausgearbeitete AR auf Eisen basiert, wurde entschieden, für die Bioverfügbarkeit der chemischen Formen, die für die Supplementierungsexposition eingesetzt wurden, keinen Skalierfaktor anzuwenden. Stattdessen wird nach der Kalkulation der Supplementierungsexposition für Eisen eine Umwandlung in die Supplementierungsform Eisensulfat und Eisenbisglycinat durchgeführt, die auf dem Molekulargewicht (mw) und dem Unterschied in der Bioverfügbarkeit basiert. Daher wird im vorliegenden Fall für Eisen ein ED50 von 6 mg Eisen/Tag für die allgemeine Population mit einer Decision-Inzidenz von 1:100 vorgeschlagen. Der Standard CV von 15% wird für die Nutzenkalkulationen angewendet.
4.3.2.4. Risiko
Eisenbisglycinat
Eisenbisglycinat hat eine niedrige Toxizität; in einer 13-wöchigen Studie mit Ratten wurde ein NOAEL von 500 mg/kg Körpergewicht/d festgestellt, was die höchste getestete Dosis war. Darüber hinaus wurde bei Feldversuchen in Entwicklungsländern festgestellt, dass zwischen 2 und 23 mg/Tag Eisen als Nahrungsergänzung konsumiert werden kann, ohne dass unerwünschte Wirkungen berichtet wurden. Außerdem wurde Eisenbisglycinate als Nahrungssupplementierung für Eisen bei einer Dosierung von ungefähr 15 bis 120 mg Eisen/Tag von Erwachsenen und Schwangeren mit einem normalen Eisenstatus und im Besonderen von jungen Kindern mit Eisenmangel gut vertragen. Darüber hinaus gab es keinen Nachweis für eine Eisenüberfrachtung bei Personen, die mit Eisen reichlich ausgestattet sind (EFSA, 2006 EFSA. (2006). Opinion of the scientific panel on food additives, flavourings, processing aids and materials in contact with food on a request from the commission related to ferrous bisglycinate as a source of iron for use in the manufacturing of foods and in food supplements. EFSA J. 299:1–17. [Google Scholar]).
Eisensulfat
Die EFSA bewertete 2004 verschiedene Formen von Eisen einschließlich Eisensulfat. In dieser Bewertung wurde über Toxizitätsstudien bei Tieren berichtet, bei denen nach oraler Gabe von eisenhaltigen Präparaten im Bereich 200-650 mg Eisen/kg Körpergewicht eine akute Toxizität in Mäusen aufgetreten ist, wobei Eisensulfat am toxischsten war und Eisenfumarat am wenigsten toxisch. Die Gabe von 50 und 100 mg Eisen/kg Körpergewicht/Tag für 12 Wochen verringerte potentiell die Wachstumsrate bei männlichen Ratten in der Reihenfolge Eisensulfat>Succinat>Fumarat>Gluconat. Darüber hinaus rief eine tägliche Dosis von 50 mg Eisen eine höhere Inzidenz von gastrointestinalen Wirkungen bei Menschen hervor, denen herkömmliches Eisensulfat gegeben wurde, im Vergleich mit Personen, die die gleiche Dosis in einer Wachs-Matrix erhielten, und ebenfalls bei Personen, denen Eisensulfat verabreicht wurde, im Vergleich mit Personen, denen die gleiche Menge Eisen als Eisenbisglycinat gegeben wurde (EFSA, 2004 EFSA. (2004). Opinion of the scientific panel on dietetic products, nutrition and allergies on a request from the commission related to the tolerable upper intake level of iron. EFSA J. 125:1–34. [Google Scholar]).
Auf der Grundlage der vorhandenen Daten konnte ein ED50 aufgrund fehelender Dosis-Wirkungs-Daten nicht abgeleitet werden. Jedoch kann eine niedrigste Wirkungsstufe definiert werden, die auf den Ergebnissen der Studien über gastrointestinale (GI) Nebenwirkungen beim Menschen basieren, wie von der EFSA berichtet wurde (2004 EFSA. (2004). Opinion of the scientific panel on dietetic products, nutrition and allergies on a request from the commission related to the tolerable upper intake level of iron. EFSA J. 125:1–34. [Google Scholar]). Zu den Nebenwirkungen oraler Eisenpräparate bei therapeutischen Dosierungen von 50-220 mg Eisen/Tag gehören Übelkeit, Erbrechen, Sodbrennen, epigastrisches Unwohlsein, Durchfall und starke Verstopfung. Da Eisensulfat mit einer höheren Toxizität indiziert ist als die anderen Formen von Eisen, die von der EFSA berücksichtigt wurden, wurde die niedrigste erwähnte Wirkungsstufe für den ED50-Wert berücksichtigt. Daher wird für Eisensulfat ein ED50 von 50 mg/Tag als eine niedrige Wirkungsstufe erachtet. Wenn man die Unwägbarkeit dieser Stufe berücksichtigt, die als ED50 verwendet werden soll, wird ein Unsicherheitsfaktor von 2 als Skalierfaktor berücksichtigt.
4.3.2.5. Ausprägungsgrad des Risikos
Wenn man die Unterschiede der berichteten Toxizitätsdaten von Tieren berücksichtigt und in Betracht zieht, dass Eisensulfat bei Dosierungen von 50 mg und höher gastrointestinale Schmerzen hervorruft, wohingegen diese Wirkungen für Eisenbisglycinat bis zu einer Dosierung von 120 mg Eisen/Tag nicht berichtet wurden, lässt sich schlussfolgern, dass beide Formen von Eisen nicht bewerten werden können, wenn der gleiche ED50-Wert verwendet wird.
Für die vorliegende Bewertung wird ein ED50 von 120 mg Eisen/Tag, als Eisenbisglycinat, berücksichtigt. Falls keine Wirkung bei dem ED50 berücksichtigt wird, der als Ausgangspunkt verwendet wird, wird der Ausprägungsgrad auf eine angemessene Inzidenz von 1:10 bezogen. Wenn man in Betracht zieht, dass eine signifikante Anzahl Humandaten dieser Zahl zugrunde liegt, wird kein Skalierfaktor berücksichtigt. Daher wird ein ED50 von 120 mg/Tag mit einer Decision-Inzidenz von 1:10 für Eisenbisglycinat vorgeschlagen.
Die GI Nebenwirkungen von Eisensulfat im oberen Magen-Darm-Trakt hängen von den lokalen Eisenkonzentrationen ab und beruhen auf einer Reizung der Schleimhaut, Veränderung der gastrointestinalen Motilität und/oder einem schnellen Übergang von Eisen in den Blutkreislauf. Der Ausprägungsgrad gastrointestinaler Beschwerden wird als „Klinische Symptome, die auf eine geringfügige, aber umkehrbare Änderung hinweisen“ eingestuft, für die eine angemessene Inzidenz von 1:1.000 berücksichtigt wird. Wenn man den Skalierfaktor von 2 als Ergebnis der Anwendung eines LOAEL hinzufügt, wird eine Decision-Inzidenz von 1:2.000 für Risikomanagement-Zwecke berücksichtigt. Daher wird ein ED50 von 50 mg Eisen/Tag mit einer Decision-Inzidenz von 1:2.000 für Eisensulfat vorgeschlagen.
Der Standard CV von 45% wird für die Risikokalkulationen beider Formen verwendet.
4.3.2.6. Risiko-Nutzen-Analyse
Die Einnahmekalkulationen bei vordefinierten Nutzen-/Risiko-Inzidenzen werden in Tabelle 5 gezeigt. Tabelle 6 gibt einen Überblick über die Einnahmewerte bei den entsprechenden Decision-Inzidenzen. Darüber hinaus wurden die relevantesten Einnahmezahlen, wie sie in Tabelle 6 gezeigt werden, für die vorliegende Bewertung berücksichtigt. Im Grunde genommen werden die niedrigste P5 Einnahmezahl und die höchste P95 Einnahmezahl für Erwachsene für die Bewertung berücksichtigt, um den Nutzen und entsprechend das Risiko zu bewerten.
Tabelle 5. Kalkulation der Einnahme von Eisen bei vordefinierten Inzidenzen für Nutzen und Risiko.
Tabelle 6. Überblick über ED50-Werte, Einnahme an den Nutzen/Risiko-Decision-Inzidenzen und Einnahme von Eisen via die Nahrung.
Wenn man die Decision-Nutzen-/Risiko-Inzidenzen und die Einnahme von Eisen aus der Nahrung (Tabelle 6) berücksichtigt, kann gefolgert werden, dass:
- Ein deutlicher Unterschied zeigt sich für die berechnete Einnahme bei der vordefinierten Inzidenz für Eisensulfat und Eisenbisglycinat, der auf den jeweiligen betreffenden Decision-Risiko-Inzidenzen basiert. Die höchste Einnahme für Eisensulfat (13,1 mg Eisen/Tag) liegt bei etwa 20% der höchsten Einnahme, die für Eisenbisglycinat (69,2 mg Eisen/Tag) berechnet wurde;
- Die Einnahme von Eisen bei der Decision-Nutzen-Inzidenz von 1:100, nämlich 8,5 mg/Tag, liegt zwischen der Einnahmezahl P5 (7,2 mg/Tag) und der Einnahmezahl P50 (10,7 mg/Tag) für Erwachsene in der allgemeinen Population; eine signifikante Anzahl von Personen hat daher eine Einnahmemenge von Eisen, die unter der Einnahmemenge bei der Decision-Nutzen-Inzidenz liegt;
- Die Verwendung von Ergänzungsmitteln kann die Einnahmemenge von Eisen erhöhen, so dass eine zusätzliche Einnahme von 1,3 mg Eisen/Tag die Einnahme bei der P5 Einnahmestufe (von 7,2 mg Eisen/Tag) auf die Stufe der Decision-Nutzen-Inzidenz von 1:100 für Eisen anhebt. Dies kann durch eine Supplementierung von 7 mg Eisensulfat (1,3 / 55,8 [mw Eisen] * 152 [mw Eisensulfat] * 2 [Bioverfügbarkeitsfaktor]) oder 4,8 mg Eisenbisglycinat (1,3 / 55,8 [mw Eisen] * 204 [mw Eisenbisglycinat]) erreicht werden.
- Bei Eisensulfat liegt die kombinierte gesamte Einnahmemenge von Eisen via Nahrung und Supplementierung über der Einnahme bei der Decision-Risiko-Inzidenz bei der höchsten Expositionseinnahme (P95), so dass an diesem Punkt über gastrointestinale Beschwerden bei 10% der Population berichtet werden könnte, die höheren Eisen-Einnahmemengen ausgesetzt ist.
- Bei Eisenbisglycinat liegt die kombinierte Einnahmemenge via Nahrung und Supplementierungseinnahme weit unterhalb der Einnahme bei der Decison-Risiko-Inzidenz, auch bei Konsumenten mit hohen Einnahmemengen; es gibt daher keine Bedenken in Bezug auf die Sicherheit.
Zu beachten ist, dass der ED50 für Eisensulfat auf gastrointestinalen Beschwerden basiert. Diese Auswirkung kann in Zusammenhang stehen mit einer Einnahme, ohne dass eine Mahlzeit eingenommen wird. Im Fall, dass Ergänzungsmittel zusammen mit der Nahrung eingenommen werden, werden diese Auswirkungen als eingeschränkt oder sogar als nicht vorhanden betrachtet; im Falle von Ergänzungsmitteln könnte man solche Risiken über eine ausreichende Etikettierung handhaben. Dieser Aspekt wurde im vorliegenden Fall nicht weiter berücksichtigt.
5. Diskussion und Schlussfolgerung
Diese Arbeit stellt eine machbare, wissenschaftlich basierte Methodologie vor, die von Risiko-Managern für die Bestimmung von MPLs verwendet werden kann, z. B. angesichts der Anforderungen von Direktive 2002/46/EC (Artikel 5). Wenn man sowohl das Risiko, als auch den Nutzen in Betracht zieht, erlaubt dieser Ansatz für die jeweilige betreffende Populationsgruppe die Bestimmung des optimalen Bereichs für die Einnahme von Ergänzungsmitteln in unterschiedlichen Formen von Mikronährstoffen; nicht nur Nutzen und Risiko, sondern auch der Ausprägungsgrad der Wirkungen werden bei der Entscheidungsfindung berücksichtigt. Ein Risiko-Manager muss imstande sein, das mögliche Restrisiko in Betracht zu ziehen, angesichts dessen – wie es bei herkömmlichen Lebensmitteln der Falls ist – dass es oft nicht möglich ist, den Nutzen für die Mehrheit der Population sicherzustellen, ohne den Teil der Population mit einer hohen Einnahmemenge irgendeiner Art von Risiko auszusetzen (Verkerk, 2010 Verkerk, R. (2010). The paradox of overlapping micronutrient risks and benefits obligates risk/benefit analysis. Toxicology 278(1):27–38.[Crossref], [PubMed], [Web of Science ®], [Google Scholar]). Der in diesem Paper vorgeschlagene Risiko-Nutzen-Ansatz basiert auf dem berechneten ED50, dem Ausprägungsgrad der bedenklichen Wirkungen und seiner damit verbundenen ‚angemessenen‘ Inzidenz in Bezug auf Mangel und Toxizität einer bestimmten Form des Mikronährstoffes und ermöglicht einen Vergleich im 1:1-Maßstab, was die proportionale Entscheidungsfindung beim Risikomanagement wesentlich erleichtert. Es ist zu beachten, dass Risikomanagement Bewertungen unter Anwendung des Risiko-Index – der aus dem Einfluss eines Risikoereignisses × Eintrittswahrscheinlichkeit besteht – sich nicht grundlegend von der Bewertung des Einflusses eines Risikoereignisses unterscheiden, und zwar entsprechend dem Ausprägungsgrad einer bestimmten Gesundheitsbeeinträchtigung in Bezug auf die Decison-Inzdenz, die für die beobachtete Gesundheitsbeeinträchtigung als vertretbar erachtet wird. Die Eintrittswahrscheinlichkeit kann wiederum anhand der Inzidenzdaten der Wirkung bei einer bestimmten Dosierung eingeschätzt werden.
5.1. Risikomanagement
Die Risiko-Manager benötigen einen ausreichenden und anschaulichen Bericht über die Natur und den Ausprägungsgrad der nützlichen (einen Mangel verhindernden) und unerwünschten toxischen Wirkungen auf die Gesundheit, die verwendet wurden, um die ED50-Werte abzuleiten, zusammen mit dem Expositionsbereich für bestimmte Subpopulationen. Dies ermöglicht es dem Risiko-Manager, die Akzeptierbarkeit jeglicher Inzidenz gegenüber dem Ausprägungsgrad der Wirkung abzuwägen. Zum Beispiel kann ein Risiko-Manager eine erhöhte Inzidenz von 1:10 aufgrund einer Veränderung in einer Enzymaktivität bei hoher Exposition zugunsten einer verringerten Inzidenz aufgrund eines Mangelsymptoms, wie fetale Neuralrohrdefekte nach der Einnahme von Folat, akzeptieren. Dies könnte der Fall sein, wenn die Enzymaktivität ein empfindsamer Indikator für Toxizität ist; dies steht normalerweise in Zusammenhang mit einer angemessenen Inzidenz von 1:100. Die Fälle über Folsäure und Eisen, wie in Abschnitt 4.3 beschrieben, zeigen Beispiele der Erwägungen des Risikomanagements und das vorbehaltlose Abwägen von Inzidenz und Ausprägungsgrad, um eine akzeptable zusätzliche Einnahme via Nahrungsergänzungsmittel zu erhalten. Da Richtlinien derzeit nicht zur Verfügung stehen, die die Risiko-Manager darüber informieren, wie sie mit den unterschiedlichen Arten von Risiko umgehen oder diese handhaben sollen, ist ein guter Informationsaustausch und Zusammenarbeit zwischen den Risiko-Abschätzern und Risiko-Managern unentbehrlich, um über die auszuarbeitenden MPLs zu entscheiden.
Bei der Bewertung von Nutzen oder Risiko einer zusätzlichen Exposition durch Nahrungsergänzungsmittel oberhalb einer Hintergrund-Exposition durch herkömmliche Nahrung ist es wesentlich, dass Unterschiede zwischen der Einnahme von Ergänzungsmitteln und der Einnahme von herkömmlichen und angereicherten Lebensmitteln berücksichtigt werden. Das Ergebnis des Ansatzes, z. B. die Bandbreite der Exposition, belegt die gesamte Exposition gegenüber einem Mikronährstoff. Der Risiko-Manager muss in der Tat darüber entscheiden, welcher Teil der gesamten Exposition vom Nahrungsergänzungsmittel im Verhältnis zu der normalen Einnahme via die Nahrung übernommen werden kann. In diesem Prozess sollten auch Subpopulationen, die dem Risiko eines Mangels an Mikronährstoffen via die normale Nahrung ausgesetzt sein könnten, berücksichtigt werden. In dem beschriebenen Fall über Eisen ist es nennenswert, dass die Ernährung kaum zu einer Einnahme bei der Decision-Nutzen-Inzidenz (von 8,5 mg/Tag) führt, die für Erwachsene berechnet wurde.
Es kann außerdem relevant sein, wenn man Risiken berücksichtigt, die durch den unbewussten Verzehr von Mikronährstoffen entstehen könnten, insbesondere jene in herkömmlichen Lebensmitteln (z. B. Retinol in der Leber) gegenüber jenen, die als Ergänzungsmittel eingenommen werden, bei denen die Herkunft des Mikronährstoffes deutlich als solche erkennbar ist, z. B. durch die pharmazeutische Form oder das Aussehen, durch Nährwertangaben auf dem Etikett etc. Darüber hinaus sollten auch Rezepturbemühungen für Ergänzungsmittel unter Verwendung der neuesten verfügbaren Daten berücksichtigt werden, z. B. der mögliche Einfluss auf Populationsgruppen oder die Bioverfügbarkeit für Kombinationspräparate aus Folat und Vitamin B12 oder Kupfer mit Zink.
Der letzte Schritt beim Risikomanagement kombiniert die Bemühungen und übersetzt diese in eine (Risiko-)Kommunikation, höchst wahrscheinlich durch eine abgestufte Response. Dies kann eine eindeutige Etikettierung einschließlich Vorsichtsmaßnahmen sein, die sich an eine identifizierte Risiko-Subpopulation richtet, detaillierte Anweisungen für den Konsumenten, die dazu gedacht sind, das Risiko zu minimieren und den Nutzen zu optimieren, und das Einbinden der vorgeschriebenen Angaben über die Menge des Mikronährstoffes im Vergleich zu Referenzeinnahmen. Während es für Nahrungsergänzungsmittel Richtlinien für die Etikettierung gibt, gibt es bisher noch keine harmonisierten Warnhinweise für eine hohe Einnahme, die für einige Subpopulationen nützlich sein könnte, während sie andere einem Risiko aussetzt. Eine klare Information kann auch dem Missbrauch eines bestimmten Produktes durch nichtbestimmungsgemäße Populationsgruppen vorbeugen oder der übermäßigen Nutzung durch die bestimmungsgemäße Populationsgruppe. Der wichtigste Punkt besteht darin, ein Bewusstsein für die Einnahme von Mikronährstoffen durch den Konsumenten über alle Quellen hinweg zu schaffen.
Ein Risiko-Manager muss einen weiten Bereich von Verantwortlichkeiten unterstützen, einschließlich einer sorgfältigen Berücksichtigung der neuesten wissenschaftlichen Daten über Nutzen und Risiko von Mikronährstoffen, wie dies in Zusammenhang steht mit bestimmten chemischen Formen der Mikronährstoffe oder nicht, Interessen der Stakeholder, soziale Bedürfnisse und natürlich die Sicherheit der Konsumenten und Auswahl. Es ist zu beachten, dass das vorliegende Paper auf einen wissenschaftlichen Ansatz zur Anwendung für das Risikomanagement bei Mikronährstoffen fokussiert ist und nicht speziell für das Risikomanagement an sich. Der Wert der Ergebnisse auf Grundlage der Anwendung des vorgeschlagenen Ansatzes wird durch die Qualität der verfügbaren relevanten Daten beeinflusst; der Ansatz gleicht keineswegs Probleme im Zusammenhang mit unzureichenden Daten aus.
5.2. Vorteile des Risiko-Nutzen-Ansatzes
Wenn man davon ausgeht, dass dieser wissenschaftliche Ansatz für das Risikomanagement von Mikronährstoffen angewendet wird, wird die Arbeit von Renwick et al. (2004 Renwick, A. G., et al. (2004). Risk-benefit analysis of micronutrients. Food Chem.Toxicol. 42(12):1903–1922.[Crossref], [PubMed], [Web of Science ®], [Google Scholar]) als solide Plattform für eine weitere Entwicklung erachtet. Mit den in diesem Paper beschriebenen, vorgeschlagenen Adaptionen und Erweiterungen steht ein praktischer und quantitativer Ansatz für das Risikomanagement für Mikronährstoffe zur Verfügung, der alle relevanten verfügbaren Daten berücksichtigen kann, z. B. toxikologisches Risiko, nützliche Wirkungen, Bioverfügbarkeit, Unterschiede zwischen den chemischen Formen der Nährstoffe. Darüber hinaus werden quantitativ die Natur und der Schweregrad der Wirkung berücksichtigt sowie Inzidenzen, die für bestimmte Wirkungen akzeptabel sein könnten, und das Abfallen der Dosis-Wirkungskurve, was eine verbesserte Qualität und Sensibilität bei der Entscheidungsfindung im Risikomanagement durch das Abgleichen von Risiko und Nutzen erlaubt. Anhand der Anleitung für die Bewertung der Bioverfügbarkeitsdaten und einschließlich der harmonisierten Faktoren, die eine Umwandlung der Ergebnisse aus Tierstudien auf Menschen in Fällen zulassen, wo keine Humandaten zur Verfügung stehen, ist der Prozess zur Bestimmung eines Skalier- (oder Unsicherheits-)Faktors so objektiv wie möglich.
Abgesehen von der Anwendung für die allgemeine Population, kann der empfohlene Ansatz mühelos auf bestimmte Populationsgruppen angewendet werden, sollten Nutzen oder Risiko für eine Populationsgruppe spezifisch sein. Auf diese Art und Weise sind die Empfehlungen für eine optimale Einnahme von Ergänzungsmitteln für jede Populationsgruppe sichergestellt, ohne dass andere Gruppen beeinträchtigt werden. Zu den Faktoren, die die Notwendigkeit für einen bestimmten Ansatz für eine Subpopulation auslösen, gehören die Bioverfügbarkeit und artenspezifische Unterschiede. Wo relevante Biomarker nicht identifiziert werden können, können -omic-Daten oder systembiologische Daten über funktionale Wirkungen verwendet werden, um die Vergleichbarkeit der analog verwendeten Substanzen zu überbrücken (Ommen et al., 2009 van Ommen, B., et al. (2009). Challenging homeostasis to define biomarkers for nutrition related health. Mol. Nutr. Food Res. 53(7):795–804.[Crossref], [PubMed], [Web of Science ®], [Google Scholar] und 2010 van Ommen, B., et al. (2010). The micronutrient genomics project: A community-driven knowledge base for micronutrient research. Genes. Nutr. 5:285–296.[Crossref], [PubMed], [Web of Science ®], [Google Scholar] und Palou et al., 2009 Palou, A., et al. (2009). Integration of risk and benefit analysis–the window of benefit as a new tool. Cr. Rev. Food Sci.Nutr. 49(7):670–680.[PubMed], [Web of Science ®], [Google Scholar]). Davon ausgehend, dass es ein schnelles Aufkommen dieser Branchen der Ernährungswissenschaft geben wird, ist es wahrscheinlich, dass mehr relevante Daten dieser Art in naher Zukunft verfügbar sein werden.
Bei Fällen, wo die Wirkungen sich aufgrund unterschiedlicher Formen eines Mikronährstoffes unterscheiden, wird empfohlen, dass der Risikomanagement-Ansatz für jede Form des Mikronährstoffes separat angewendet wird. Bei Fällen, wo sich nur die systemische Bioverfügbarkeit aufgrund der unterschiedlichen Formen des Mikronährstoffes unterscheidet, sollten die MPLs korrigiert werden, die unter Berücksichtigung dieser Unterschiede in der Bioverfügbarkeit abgeleitet wurden.
5.3. Wichtigkeit der Daten
Idealerweise sollten ausreichend Daten über Risiko und Nutzen verfügbar sein, um die Dosis-Wirkungs-Kurven zu bestimmen. Dies würde die Verfügbarkeit von Studien mit Mehrfachdosierung über unerwünschte und nützliche Wirkungen für jeden Mikronährstoff (Form) für jede Zielpopulation erforderlich machen. Leider ist dies angesichts von ethischen Überlegungen, der Forschungskosten und der verfügbaren Finanzierung eine unrealistische oder nicht durchführbare Situation. Das Design für Humanstudien beinhaltet meistens Einzel- oder eingeschränkte Dosierungsstudien, die ernährungsbedingte oder nützliche Wirkungen bewerten, ohne mögliche unerwünschte Wirkungen zu berücksichtigen. Verwirrende Faktoren wie Ernährungsgewohnheiten, Ernährungsbedürfnisse unter verschiedenen Konsumentengruppen, Geschlecht, genetische Polymorphismen und geografische Unterschiede erschweren die Möglichkeit, weitere bestimmte Studiendaten durch das Studium der ernährungs- und gesundheitsbezogenen Wirkungen von Mikronährstoffen abzurufen. Als Folge unzureichender Daten zur Bestimmung einer Dosis-Wirkungs-Kurve für viele Mikronährstoffe sind die ED50-Werte Punktschätzungen, für die für Extrapolationszwecke standardisierte CVs verwendet werden können, die eine Dosisempfindlichkeit simulieren.
6. Schlussfolgerung
Der vorliegende Ansatz umfasst die ausführliche Darstellung der Einnahmemengen von Mikronährstoffen als Supplementierung und berücksichtigt eine minimale Exposition für eine normale und mögliche nützliche Körperfunktion (Nutzen) sowie eine maximale Exposition in Zusammenhang mit Toxizität (Risiko) und wird daher als vereinbar mit den Anforderungen von Artikel 5 der Direktive 2002/46/EC über Nahrungsergänzungsmittel erachtet. Für jede der beiden Formen von Folat und Eisen wurde in zwei Fällen die Flexibilität und Anwendbarkeit demonstriert. Obwohl flüchtig berücksichtigt wird, wie kürzlich veröffentlichte Daten die Ergebnisse beeinflussen könnten, sollten die Ansätze zur Bewertung der Gefahr, des Risikos, des Nutzens und der Exposition weiter ausgedehnt werden und zwar durch Literaturscreening und der letztendlichen Einbindung firmeninterner, vertraulicher, wissenschaftlicher Informationen, die alle relevanten Daten in Zusammenhang mit Mikronährstoffen und deren entsprechenden Formen beinhalten. Darüber hinaus sollten die Ergebnisse idealerweise in Bezug auf Daten aus Beobachtungsstudien und aus klinischer Erfahrung beurteilt werden, um zu bestimmen, ob eine erneute Bewertung, die mit neuen Daten, Inzidenzpunkten oder Skalierungs-/Unsicherheitsfaktoren durchgeführt wird, nötig sein könnte.
7. Interessenskonflikte
Das derzeitige Projekt wurde von der Alliance for Natural Health International (Dorking, United Kingdom) und von Solgar Vitamins (Holland) BV (Haarlem, The Netherlands) unterstützt. Sowohl ANH International als auch Solgar Vitamins (Holland) BV hatten keinerlei Einfluss auf die durch die Autoren getroffenen Entscheidungen oder gezogenen Schlussfolgerungen in Zusammenhang mit dem Projekt und/oder dem derzeitigen Manuskript. Die Autoren erklären, dass es keine Interessenskonflikte gibt.
Anerkennung
Die Autoren bedanken sich bei Geert Houben für seine unabdingbare Prüfung des Manuskripts und bei Suzanne van den Berg für ihre Hilfe bei der Bewertung der Literatur der ausgewählten Fallstudien über Folat und Eisen.
Referenzen
- Arkbåge, K., Verwei, M., Havenaar, R. and Witthöft, C. (2003). Bioaccessibility of folic acid and (6S)-5-methyltetrahydrofolate decreases after the addition of folate-binding protein to yogurt as studied in a dynamic in vitro gastrointestinal model. J. Nutr. 133(11):3678–83.
- Blakley, R. L. (1984). Dihydrofolatereductase. In: Folates and Pterins: Chemistry and Biochemistry of Folates (volume 1), pp191–244. Blakley, R. L., Benkovic, S. J., editors. Wiley, New York.
- Bruins, M.J., et al. (2015). Addressing the risk of inadequate and excessive micronutrient intakes: traditional versus new approaches to setting adequate and safe micronutrient levels in foods. Food Nutr. Res. 59.
- Casgrain, A., et al. (2010). Micronutrient bioavailability research priorities. Am. J. Clin. Nutr. 91:1423S–1429S.
- Duque, X., et al. (2014). Effect of supplementation with ferrous sulfate or iron bis-glycinate chelate on ferritin concentration in Mexican schoolchildren: a randomized controlled trial. Nutr. J. 13:71–81.
- EFSA. (2004). Opinion of the scientific panel on dietetic products, nutrition and allergies on a request from the commission related to the tolerable upper intake level of iron. EFSA J. 125:1–34.
- EFSA. (2006). Opinion of the scientific panel on food additives, flavourings, processing aids and materials in contact with food on a request from the commission related to ferrous bisglycinate as a source of iron for use in the manufacturing of foods and in food supplements. EFSA J. 299:1–17.
- EFSA. (2006). Tolerable upper intake levels for vitamins and minerals, scientific committee on food and scientific panel on dietetic products, nutrition and allergies. ISBN: 9291990140; Available at http://www.efsa.europa.eu/en/ndatopics/docs/ndatolerableuil.pdf.
- EFSA. (2010a). Scientific opinion on principles for deriving and applying dietary reference values. EFSA J. 8(3):1458.
- EFSA. (2010b). Guidance on human health risk-benefit assessment of foods. EFSA J. 8(7):1673.
- EFSA. (2012). Guidance on selected default values to be used by the EFSA scientific committee, scientific panels and units in the absence of actual measured data. EFSA J. 10(3):2579.
- EFSA. (2014). Scientific opinion on dietary reference values for folate. EFSA J. 12(11):3893.
- EFSA. (2015a). Available at http://www.efsa.europa.eu/en/datexfoodcdb/datexfooddb.
- EFSA. (2015b). Scientific opinion on dietary reference values for iron. EFSA J. 13(10):4254.
- ERNA/EHPM. (2004). Vitamin and mineral supplements: a risk management model. ISBN 9080920614. Pgs. 1–23.
- Etcheverry, et al. (2012). Application of in vitro bioaccessibility and bioavailability methods for calcium, carotenoids, folate, iron, magnesium, polyphenols, zinc and vitamins B6, B12, D and E. Front. Physiol. 3:1–22.
- European Commission. (2006). Discussion paper on the setting of maximum and minimum amounts for vitamins and minerals in foodstuffs. Available at http://ec.europa.eu/food/food/labellingnutrition/supplements/discus_paper_amount_vitamins.pdf.
- European Commission. (2007). Orientation paper on the setting of maximum and minimum amounts for vitamins and minerals in foodstuffs. Reference no. Sanco/E4/FDA/bs(2007)D/540510. Pgs. 1–23.
- Fairweather-Tait, S. J., et al. (2011). Risk-benefit analysis of mineral intakes: case studies on copper and iron. Proc. Nutr. Soc. 70:1–9.
- Ferrari, P., et al. (2012). Treatment of mild non-chemotherapy-induced iron deficiency anemia in cancer patients: comparison between oral ferrous bisglycinate chelate and ferrous sulfate. Biomed Pharmacother. 66(6):414–418. doi: 10.1016/j.biopha.2012.06.003.
- Flynn, A., et al. (2009). Intake of selected nutrients from foods, from fortification and from supplements in various European countries. Food Nutr.Res. 12:1–51.
- Gregory, J. F. (1995). The bioavailability of folate. In: Folate: Nutritional and Clinical Perspectives (Bailey, L., ed), pp. 195–235. New York: Marcel Dekker.
- Gregory, J. F. (2001). Bioavailability of nutrients and other bioactive components from dietary supplements. case study: Folate bioavailability. J. Nutr. 131:1376S–1382S.
- IOM National Research Council. (1998). Dietary Reference Intakes for Thiamin, Riboflavin, Niacin, Vitamin B6, Folate, Vitamin B12, Pantothenic Acid, Biotin, and Choline. The National Academies Press, Washington, DC. Available at http://www.nap.edu/catalog/6015.html.
- IOM National Research Council. (2001). Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Zinc; Available at http://www.nap.edu/catalog/10026.html
- Milman, N., et al. (2014). Ferrous bisglycinate 25 mg iron is as effective as ferrous sulfate 50 mg iron in the prophylaxis of iron deficiency and anemia during pregnancy in a randomized trial. J. Perinat. Med. 42(2):197–206. doi: 10.1515/jpm-2013-0153.
- NHANES: National Health and Nutrition Examination Survey of the US Center for Disease Control and Prevention. Available at http://www.cdc.gov/nchs/nhanes.htm.
- NTP. (2015). National toxicology program. Draft NTP monograph for the expert panel: identifying research needs for assessing safe use of high intakes of folic acid. (Available at http://ntp.niehs.nih.gov/ntp/about_ntp/ntpexpanel/2015/draft_monograph_folic_acid_508.pdf; July, 2015).
- Öhrvik, V. (2009). Folate bioavailability in vitro experiments and human trials. Doctoral thesis of the Swedish University of Agricultural Sciences, Uppsala, ISBN 978-91-576-7410-4.
- Palou, A., et al. (2009). Integration of risk and benefit analysis–the window of benefit as a new tool. Cr. Rev. Food Sci.Nutr. 49(7):670–680.
- Pentieva, et al. (2004). The short-term bioavailabilities of (6S)-5-methyltetrahydrofolate and folic acid are equivalent in men. Human Nutr.Metab. 134:580–585.
- Pietzrik, K., et al. (2010). Folic acid and L-5-methyltetrahydrofolate: comparison of clinical pharmacokinetics and pharmacodynamics. Clin. Pharmacokinet. 49(8):535–548.
- Prinz-Langenohl, R., et al. (2003). Effect of folic acid preload on the bioequivalence of [6S]-5-methyltetrahydrofolate and folic acid in healthy volunteers. J. Inherit. Metab. Dis. 26(Suppl 1):124.
- Renwick, A. G., et al. (2004). Risk-benefit analysis of micronutrients. Food Chem.Toxicol. 42(12):1903–1922.
- Richardson, D. P. (2014). Nutritional risk analysis approaches for establishing maximum levels of vitamins and minerals in food (dietary) supplements. Prepared on behalf of IADSA.
- Rossum, C. T. M. van, et al. (2011). Dutch National Food Consumption Survey 2007-2010. RIVM Report 350050006. Available at http://www.rivm.nl/bibliotheek/rapporten/350050006.pdf
- Shea, B., et al. (2013). Folic acid and folinic acid for reducing side effects in patients receiving methotrexate for rheumatoid arthritis (Review). Cochrane Database Syst. Rev. 5. DOI: 10.1002/14651858.CD000951.pub2.
- Tijhuis, M. J., et al. (2012). State of the art in benefit-risk analysis: Food and nutrition. Food Chem. Toxicol. 50:5–25.
- van Ommen, B., et al. (2009). Challenging homeostasis to define biomarkers for nutrition related health. Mol. Nutr. Food Res. 53(7):795–804.
- van Ommen, B., et al. (2010). The micronutrient genomics project: A community-driven knowledge base for micronutrient research. Genes. Nutr. 5:285–296.
- Verkerk, R. (2010). The paradox of overlapping micronutrient risks and benefits obligates risk/benefit analysis. Toxicology 278(1):27–38.
- Yang, T. L., et al. (2005). A long-term controlled folate feeding study in young women supports the validity of the 1.7 multiplier in the dietary folate equivalency equation. J. Nutr. 135:1139–1145.